药理学/抗菌机制、影响抗菌作用因素及细菌耐药性
| 医学电子书 >> 《药理学》 >> β-内酰胺类抗生素 >> 抗菌机制、影响抗菌作用因素及细菌耐药性 |
| 药理学 |
|
|
|
(一)抗菌作用机制
各种β-内酰胺类抗生素的作用机制均相似,都能抑制胞壁粘肽合成酶,即青霉素结合蛋白(penicillin binding proteins,PBPs),从而阻碍细胞壁粘肽合成,使细菌胞壁缺损,菌体膨胀裂解(胞壁粘肽合成过程见三十七章)。除此之外,对细菌的致死效应还应包括触发细菌的自溶酶活性,缺乏自溶酶的突变株则表现出耐药性。哺乳动物无细胞壁,不受β-内酰胺类药物的影响,因而本类药具有对细菌的选择性杀菌作用,对宿主毒性小。近十多年来已证实细菌胞浆膜上特殊蛋白PBPs是β-内酰胺类药的作用靶位,PBPs的功能及与抗生素结合情况归纳于图38-1。各种细菌细胞膜上的PBPs数目、分子量、对β-内酰胺类抗生素的敏感性不同,但分类学上相近的细菌,其PBPs类型及生理功能则相似。例如大肠杆菌有7种PBPs,PBP1A,PBP1B与细菌延长有关,青霉素、氨苄西林、头孢噻吩等与PBP1A、PBP1B有高度亲和力,可使细菌生长繁殖和延伸受抑制,并溶解死亡,PBP2与细管形状有关,美西林、棒酸与硫霉素(亚胺培南)能选择性地与其结合,使细菌形成大圆形细胞,对渗透压稳定,可继续生几代后才溶解死亡。PBP3功能与PBP1A相同,但量少,与中隔形成,细菌分裂有关,多数青霉素类或头孢菌素类抗生素主要与PBP1和(或)PBP3结合,形成丝状体和球形体,使细菌发生变形萎缩,逐渐溶解死亡。PBP1,2,3是细菌存活、生长繁殖所必需,PBP4,5,6;与羧肽酶活性有关,对细菌生存繁殖无重要性,抗生素与之结合后,对细菌无影响。

图38-1 大肠杆菌PBPs的酶功能及与其结合的抗生素的作用
(二)影响β-内酰胺类抗菌作用素
革兰阳性菌与阴性菌的结构差异甚大,β-内酰胺类各药与母核相联接的侧链不同可影响其亲脂性或亲水性。有效药物必需能进入菌体作用于细胞膜上的靶位PBPs。影响抗菌作用的主要因素:①药物透过革兰阳性菌细胞壁或阴性菌脂蛋白外膜(即第一道穿透屏障)的难易;②对β-内酰胺酶(第二道酶水解屏障)的稳定性;③对抗菌作用靶位PBPs的亲和性。根据这些因素,目前临床应用的β-内酰胺类对革兰阳性与阴性菌的作用大致有6种类型(见图38-2)。
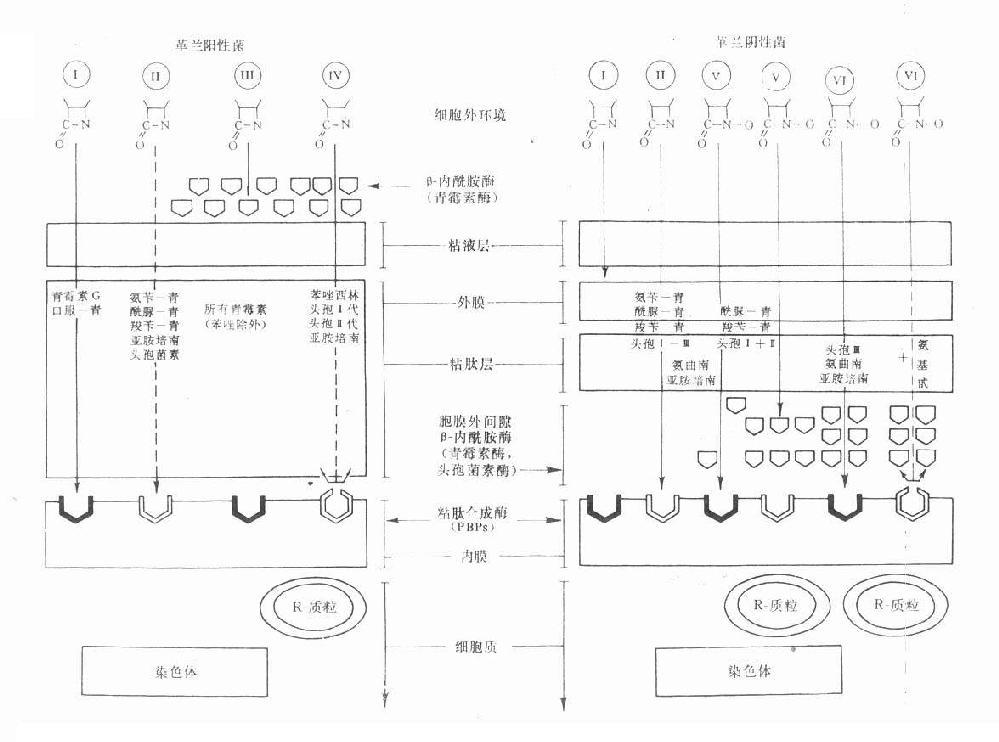
图38-2 革兰阳性与阴性菌的结构及β内酰胺类药的穿透情况及其对β-内酰胺酶与胞壁合成酶(PBPs)的关系示意图
Ⅰ类为青霉素及口服青霉素V易透过革兰阳性菌胞壁粘肽层,但它们不能透过革兰阴性菌糖蛋白磷脂外膜,因而属窄谱的仅对革兰阳性菌有效。Ⅱ类包括有氨苄西林、羧苄西林、酰脲类青霉素、亚胺培南及若干头孢菌素,能适度透过革兰阳性菌的胞壁粘肽层,对革兰阴性菌的外膜透过性则很好,因而是广谱抗菌药物。Ⅲ类为青霉素等容易被革兰阳性菌的胞外β-内酰胺酶即青霉素酶破坏灭活的青霉素类,对产酶菌往往表现明显的耐药性。Ⅳ类为异噁唑类青霉素、头孢菌素一、二代及亚胺培南等对青霉素酶稳定,对革兰阳性的产酶菌有效,但对染色体突变而改变的PBPs结构,可使药物与PBPs的亲和力下降或消失,因而无效。Ⅴ类包括酰脲类青霉素(阿洛西林与美洛西林等)、羧苄青霉素及头孢菌素一、二代,当胞膜外间隙的β-内酰胺酶少量存在时有抗菌效果,大量酶存在时,则被破坏而无效。Ⅵ类包括第三代头孢菌素、氨曲南、亚胺培南等对β-内酰胺酶十分稳定,即使大量β-内酰胺酶存在时仍然有效,但对因染色体突变而改变了的PBPs则无效,加用氨基甙类抗生素也仍然无效。
(三)细菌耐药机制
细菌对β-内酰胺类抗生素耐药机制可概括为:①细菌产生β-内酰胺酶(青霉素酶、头孢菌素酶等)使易感抗生素水解而灭活;②对革兰阴性菌产生的β-内酰胺酶稳定的广谱青霉素和第二、三代头孢菌素,其耐药发生机制不是由于抗生素被β-内酰胺酶水解,而是由于抗生素与大量的β-内酰胺酶迅速、牢固结合,使其停留于胞膜外间隙中,因而不能进入靶位(PBPs)发生抗菌作用。此种β-内酰胺酶的非水解机制又称为“牵制机制”(trappingmechanism);③PBPs靶蛋白与抗生素亲和力降低、PBPs增多或产生新的PBPs均可使抗生素失去抗菌作用。例如MRSA(methicillin resistant Staphylococcusaureus)具有多重耐药性,其产生机制是PBPs改变的结果,高度耐药性系由于原有的PBP2与PBP3之间产生一种新的PBP2'(即PBP2a),低、中度耐药系由于PBPs的产量增多或与甲氧西林等的亲和力下降所致;④细菌的细胞壁或外膜的通透性改变,使抗生素不能或很少进入细菌体内到达作用靶位。革兰阴性菌的外膜是限制β-内酰胺类抗生素透入菌体的第一道屏障。近年研究已证实抗生素透入外膜有非特异性通道与特异性通道两种。大肠杆菌K-12外膜有亲水性的非特异性孔道蛋白(porin)为三聚体结构,有二个孔道蛋白,即OmpF与OmpC,其合成由OmpB3基因调控。OmpF的直径为1nm,许多重要的β-内酰胺类抗生素大多经过此通道扩散入菌体内。鼠伤寒杆菌OmpF与OmpC缺陷突变株对头孢噻啶的通透性要比野生株小10倍,因而耐药。仅含微量OmpF与OmpC的大肠杆菌突变株,对头孢唑啉、头孢噻吩的透入也较野生株成倍降低,其MIC明显增高,也出现耐药。绿脓杆菌对β-内酰胺类抗生素耐药性的产生已证明是由于外膜非特异性孔道蛋白OprF缺陷而引起的。革兰阴性外膜的特异性通道,在绿脓杆菌耐亚胺培南的突变株已证明系由于外膜缺失一种分子量为45~46kD蛋白OprD。如将此OprD重组于缺陷OprD的突变株外膜蛋白脂质体中,又可使亚胺培南透过性增加5倍以上,其MIC也相应地降低,于是细菌的耐药性消除。⑤由于细菌缺少自溶酶而出现细菌对抗生素的耐药性,即抗生素具有正常的抑菌作用,但杀菌作用差。
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 关于“药理学/抗菌机制、影响抗菌作用因素及细菌耐药性”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |