凝血酶原
| A+医学百科 >> 凝血酶原 |
凝血酶原 prothrombin
血液凝固因子之一。存在于血浆中,亦称第Ⅱ因子。是凝血酶的前身物质,血浆中含量为10-15毫克/分升,分子量为68000的糖蛋白。糖的含量约占11%,其中含有半乳糖、甘露糖、岩藻糖、氨基已糖、唾液酸。电泳上,它分布在α2-球蛋白部分,等电点为pH4.2。含于Cohn分带Ⅲ/2之中。可被67%饱和的硫酸铵盐析。可用BaSO4、MgSO4吸附。在机体内的半减期为23—36小时。它在凝血过程中变为凝血酶,其大部分可被消耗掉,残存在血清中者在15%以下。凝血酶原生成于肝脏,生成时有维生素K参与。
目录 |
凝血酶原的组成
凝血酶原是由肝脏合成的维生素K依赖因子之一(其他有因子Ⅶ、Ⅸ、Ⅹ、蛋白C、蛋白S和骨-羧基谷氨酸蛋白质)。含579个氨基酸残基的单链糖蛋白,分子量72,000.自N-末端起,有1个Gla区(1-40),2个环区(41-271)和1个催化区(271-579)。Gla区内含10个r-羧基谷氨酸残基,主要功能为通过结合钙离子与磷脂联结。环区参与其与底物和辅因子间的相互作用,环区2可与FⅤa结合,并含有FⅩa的作用位点组氨酸205~精氨酸220.催化区包括激活区和丝氨酸蛋白酶区。在钙离子、FⅤa和磷脂的参与下,凝血酶原被FⅩa激活。裂解部位为精氨酸271-苏氨酸272,精氨酸320-异亮氨酸321.生成有酶活性的双链结构的凝血酶。凝血酶原单独在精氨酸320处裂解生成一个中间产物,进一步分别在精氨酸284和精氨酸155处裂解生成凝血酶和凝血酶原片段1及凝血酶原片段2.凝血酶由A链和B链经二硫键联结组成,含308个氨基酸残基,分子量36,000.A链含49个氨基酸残基,又称轻链,其功能不明。B链含259个氨基酸残基,又称重链,是酶活性所在的部位,凝血酶原催化区中的丝氨酸蛋白酶即在B链。丝氨酸蛋白酶区具有蛋白酶活性,含识别并裂解底物的部位,酶活性氨基酸为组氨酸363,天门冬氨酸419和丝氨酸525,该区精氨酸382-精氨酸393片段称为阴离子结合部位,是凝血酶原与纤维蛋白原,血栓调节蛋白和水蛭素作用的部位。
凝血酶原的作用
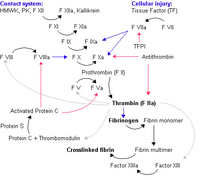
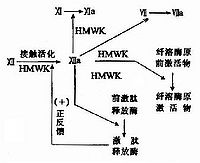
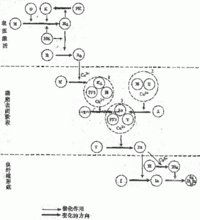
凝血酶原在凝血机制中起着中心的作用。在激活的因子Ⅴ和由血小板或其他细胞提供的磷脂表面存在的条件下,被激活的因子Ⅹ激活形成凝血酶。凝血酶是一种蛋白水解酶,对多种凝血因子具有水解作用。凝血酶使纤维蛋白原转变成纤维蛋白。另外还具有:⑴诱导血小板聚集;⑵激活ⅩⅢ因子;⑶使纤溶酶原转变成纤溶酶,从而激活纤溶系统;⑷
激活由凝血酶激活的纤溶抑制物;⑸激活因子Ⅴ、Ⅷ、Ⅺ,生成更多的凝血酶;⑹激活蛋白C系统;⑺刺激伤口愈合。因而凝血酶原缺乏或结构异常使凝血酶导致凝血机制的异常。
凝血酶原的激活
凝血酶原(Ⅱ,prothrombin)是含582氨基酸残基的酶原,被因子Xa在Arg-Thr及Arg-Ile处切开,切除N端274个氨基酸残基,余下308个氨基酸残基分成A、B两条肽链,由一个硫键相连,即为凝血酶(thrombin)。因子Va无酶活性,但可使Xa的活性增强350倍,加速凝血酶的生成。磷脂胶粒与酶(Xa)和底物(凝血酶原)之间借Ca++作为桥相连。因凝血酶原肽链的N未端含有10个γ羧基谷氨酸残基。相邻的羧基可与Ca++形成复合体。另一方面,Ca++又可与磷脂中磷酸基结合,这样使Xa和Va与凝血酶原接触在一起,于是Xa将凝血酶原水解为凝血酶凝血酶原及因子Ⅶ、Ⅺ、Ⅹ均由肝合成,合成过程中需要维素K作为辅因子。缺乏Vitk则生成异常凝血酶原,只有正常活性的1?%。研究表明Vitk参与凝血酶原γ羧基谷氨酸的生成。Vitk参与羧基化的机理为:氢醌型Vitk在酶的催化下夺去γC上的一个质子,使γ-C呈阴离子,而和CO2结合。2,3环氧Vitk则在酶催化下被硫辛酸还原而重复利用,因而Vitk在此羧化反应中起辅酶的作用。
凝血酶原基因位于第11号染色体,基因长21kb,有14个外显子和13个内含子,其mRNA为2kb.合成622个氨基酸的肽链,其中前导肽43个氨基酸,在分泌过程中裂解。虽然正常凝血酶原的核苷酸顺序和氨基酸顺序已经阐明,但其基因变异的研究没有FⅧ和FⅨ深入。凝血酶原异常有钙离子联结部位的缺陷,FⅩa裂解的缺陷和生成凝血酶活性的缺陷。与FⅧ和FⅨ相似,发生在CpG二核苷酸序列的突变更多见,单个氨基酸的取代可以发生在影响被FⅩa裂解的部位,酶活性的部位以及钙联结部位。
遗传性凝血酶原缺乏症
遗传性凝血酶原缺乏症是一种罕见的凝血因子遗传性缺陷。本病因功能正常的蛋白质合成降低所引起者又称低凝血酶原血症,而异常蛋白质分子合成引起者称为异常凝血酶原血症。前者交叉反应物质阴性,后者则阳性。目前认为异常凝血酶原血症的病例多于低凝血酶原血症。
| 关于“凝血酶原”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |