纤溶酶
| A+医学百科 >> 纤溶酶 |
纤溶酶(plasmin)是指能专一降解纤维蛋白凝胶的蛋白水解酶,是纤溶系统中的一个重要组份。体内凝血和纤溶两系统是相互依存紧密相联的。机体一旦产生凝血反应,也几乎同时激活了纤溶系统,使体内多余的血栓移去,并通过负反馈效应使体内纤维蛋白原的水平降低,从而避免纤维蛋白的过多凝聚。
目录 |
纤溶酶作用
1、降解纤维蛋白和纤维蛋白原
2、水解多种凝血因子(Ⅱ.Ⅴ.Ⅶ.Ⅷ.Ⅹ.Ⅺ)
3、使纤溶酶原转变为纤溶酶
4、水解补体等
三、纤溶过程
整个纤溶过程包括两部分,即纤溶酶原的激活及纤维蛋白或纤维蛋白原的降解。
1、纤溶酶原的激活
纤溶酶原有内源性及外源性两条激活途径。①内源性激活:指血液中存在有能使纤溶酶原激活的活化因子,它可能来自静脉或微静脉的内皮细胞,其活性在上肢静脉较之下肢静脉高,这是下肢静脉血栓比上肢静脉多的原因之一。此外在血液中还存在一种活化因子原,当机体的凝血反应一旦被启动,激活的凝血因子之一——凝血因子Ⅺ除参与自身的凝血系统外,也同时激活了此活化因子原,后者再进一步激活纤溶酶原。血液中的活化因子原极易被纤维蛋白凝块所吸附,从而有利于血栓的溶解。②外源性激活:是通过组织活化因子而实现的,此活化因子在子宫、卵巢、肾脏及肺组织中含量尤其丰富。恶性肿瘤初期的分化细胞,胎儿发育期的分化细胞,也能释放大量活化因子。此外活化因子也存在于尿、唾液、乳汁、胆汁及前列腺等分泌液中,特别是尿中的活化因子,称之为尿激酶,分子量 54 000,此酶已高度纯化,是纤溶酶原活化因子中研究得最多的。某些细菌也能产生活化因子,如链球菌所分泌的链激酶。尿激酶与链激酶都是有效的抗血栓药物。
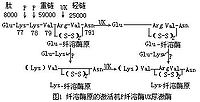
纤溶酶原的一级结构已全部阐明,是一条含 790个氨基酸残基的肽链,N末端为谷氨酸。尿激酶可按两条不同途径激活纤溶酶原(图1):①尿激酶专一裂解残基Arg-Val(560~561)间肽键,使激活成N末端为谷氨酸的纤溶酶,后者又自身裂解,作用于N端附近的肽键Lys-Lys(77~78)或Lys-Val(78~79),并释放出相应的肽段,最后形成N末端为Lys或Val的纤溶酶,此激活途径较为缓慢;②体内少量形成的纤溶酶,先使酶原降解,自N端除去77或78个氨基酸残基的肽段,形成N末端为Lys或Val的纤溶酶原,此时由于构象上的变化,较之完整的纤溶酶原更易被尿激酶所激活,最后也同样形成N末端为Lys或Val的纤溶酶。
链激酶对纤溶酶原的激活则属于接触激活。链激酶本身并不是一个酶,而是一个分子量为 47 000的蛋白质,它与纤溶酶原结合后形成一个等克分子比的复合物,使复合物中纤溶酶原的构象发生变化,并显示出活化因子的活力,自身催化其余游离的纤溶酶原,使之转变为纤溶酶。
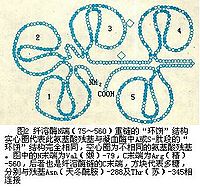
激活后的纤溶酶形成两条由两对二硫键连结的肽链。轻链为原肽链的 C端部分,共含 230个氨基酸残基,其结构类似于胰蛋白酶,酶的活性部位即位于轻链。重链的N末端为赖氨酸或缬氨酸,C末端即为激活时肽键裂解处的精氨酸。此重链部分的结构与凝血酶原N端的A及S-肽段非常类似,系由5个相似环状结构组成,同样称为“环饼”结构(图 2)。 5个环状结构很可相连接能都是同一基因重复表达产生的。环饼结构的特殊性有何功能意义,尚不清楚,有人认为体内纤维蛋白凝胶对纤溶酶的吸附很可能与此结构有关。
人血浆α2-球蛋白中含有专一抑制纤溶酶的抑制剂,称之为α2-纤溶酶抑制剂(α2-PI),它对纤溶酶有很强的亲合力,能瞬时形成复合物而使酶失活。此外血浆中的α2巨球蛋白及α1-抗胰蛋白酶在一定程度上也能抑制纤溶酶,但它们仅在有过量纤溶酶而α2-PI又不足的情况下才发挥作用。
2、纤维蛋白的降解
纤溶酶在逐步降解纤维蛋白时,释放出5个相应的降解碎片A、B、C、D、E。A、B、C为小分子,D、E为大分子。D、E两片段的分子量分别为80 000及 48 000。片段D以克分子量计算约是片段E的二倍,此外还可得到分子量更大的中间体“X”及“Y”片段。由此推测纤维蛋白的降解过程大致如下:纤维蛋白降解成“X”片段,并释放出小分子片段“A”及“B”,后者分别相当于纤维蛋白β肽链的N端部分约40~50氨基酸残基及α肽链C末端的松散部分。“X”片段再进一步降解为“D”及“ Y”片段,D片段相当于纤维蛋白单体的C端主体,而E片段则相当于纤维蛋白单体的中间主体部分,包括二硫键节的结构,“C”片段为连接纤维蛋白N端与C端二主体部位的中间螺旋区结构。
上述降解产物的片段尽管都不是均一的,但它们在电泳、超离心沉降及免疫特性上彼此都可明显区分。其中大分子量的降解产物,特别是片段“Y”具有明显的抗凝作用,即能竞争性抑制凝血酶活力,又能阻止纤维蛋白单体的聚合,从而阻止体内进一步形成纤维蛋白凝胶,这实际上是自身调节的负反馈效应。
|
||||||||||||||||||||||||||||||
| 关于“纤溶酶”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |