临床生物化学/血清酶变化的病理生理机制
| 医学电子书 >> 《临床生物化学》 >> 诊断酶学 >> 诊断酶学概述 >> 血清酶变化的病理生理机制 |
| 临床生物化学 |
|
|
|
前面已提到不同类型的酶,其变化机制会有所不同,如把所有可能影响因素都考虑进去,可以得到一个总的酶由细胞内进入血液以及在血中变化的总的模式图(图7-1):
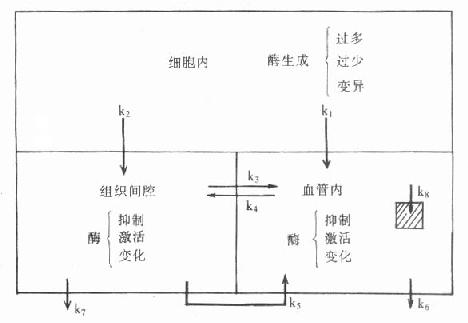
图7-1 血清酶变化机制
式中k1,k2分别代表细胞内酶进入细胞间隙或(和)直接进入血液的速率,如某些种类细胞直接与血液接触,不需经过组织间隙就直接进入血液,则血中酶变化不仅出现早而且明显。K3和k4分别代表酶从两个不同方向通过毛细血管壁的速率,某些组织或器官中毛细血管壁很致密,这些值较低,则可能有相当一部分酶经由淋巴管才进入血液,此速率常数为k5。而k6、k7则代表了酶在细胞间隙和血液的清除速率。K8代表酶被血中细胞或网状内皮系统细胞摄入的速率常数。少数酶属于血浆特异酶和分泌酶,如细胞出现增生性病变,则酶可以产生增多,并进入血液,反之也可能产生减少,从而引起血中酶浓度下降。
不同组织或器管中酶进入血中途径不一,清除方法也有差异,这就构成不同疾病酶变化的多样性,也只有在总的规律基础上,掌握各种器官疾病的特殊性,才能解释和掌握酶变化规律,正确用于临床。从临床角度,可以将上述各种因素归纳为以下四个面加以叙述。
(一)细胞酶的释放
细胞靠细胞膜来维持其完整性,细胞膜代谢十分活跃,依靠膜上一系列ATP依赖的离子泵来维持细胞内外Na+、K+和Ca2+浓度的差异,这过程需要耗费大量能源,当缺氧或能量代谢障碍、ATP供应减少、离子泵功能障碍时,无法维持正常离子的梯度差,改变了细胞的内渗透压,从而引起细胞肿胀,特别是Ca2+进入细胞内,引起细胞膜的泡状突出,膜孔隙增大,酶开始从细胞内向外溢出,其速度和数量受多种因素影响。主要的有:
⒈细胞内外酶浓度的差异 对于非血浆特异酶,细胞内外浓度差可在千倍以上,因此只要有少量细胞坏死或者细胞有轻度病变,血中酶浓度就可能明显升高。有人计算过只要有1/1000肝细胞坏死,所释放的酶可使血中酶增加一倍。鸟氨酸氨甲酰基转移酶(OCT)在细胞内外浓度差异可达到105:1,此酶在肝脏病变时变化极为明显,可惜的是,由于测定方法不方便,临床应用不多。但对于血浆特异酶而言,由于细胞内外浓度差异小,细胞病变很少引起血中酶浓度明显升高。
⒉酶在细胞内定位与存在形式 从上述酶释放的机制不难理解最容易释放入血的是胞质中游离的酶,如ALT,LD等。而在细胞亚显微结构中的酶则较难溢出,除非细胞病变进一步加重,不局限于细胞膜。特别是线粒体酶,由于有两层致密的线粒体膜,往往当细胞出现坏死病变时,才开始释放入血。在一个典型的AMI病程中,线粒体AST是最后一个出现升高的酶,而且到达峰值时间也最迟。临床通过线体酶的测定,有助于判断疾病的不良预后。又如肝细胞中AST大部分存在于线粒体,虽然其绝对量超过ALT,但在急性肝炎时,由于细胞病变较轻,胞质中含有大量ALT,故血中ALT往往超过AST。而在肝硬化时,主要病变为肝细胞坏死,线粒体中AST大量溢出,血中往往AST大于ALT。
细胞膜上也含有多种酶,如γ-谷氨酰基转移酶(GGT)大量存在于肝中毛细胆管上皮膜上,当胆道梗阻、胆汁潴留在肝中时,胆汁酸盐有表面活性剂作用,可将GGT从细胞膜上洗脱下来,而此时不一定伴有细胞膜病变。正因为血中不同酶变化机制有差异,这样GGT和ALT在各种肝胆疾病时的变化常不一致。
⒊酶蛋白分子量的大小 不少实验都证实酶的释放速度大致与酶的分子量成反比。由于临床上测定的十余种酶之间分子量差异不太大,此因素对血中酶浓度高低影响恐不如上述因素,但对酶在血中出现升高时间先后有相当大影响。例如在AMI时,血中最先升高的CK分子量为85000,而分子量为125000的LD出现升高明显推迟。
(二)酶在细胞外间隙的分布和运送
细胞中的酶经过三种途径进入血液:一种如血细胞和血管内皮细胞中的酶,不经过稀释就直接进入血液。第二种途径,细胞酶既和组织间隙也和血液直接相接触。如肝脾,它们释放的酶很快直接入血,另有小部分进入组织间隙。第三种途径,大多数组织或器官中,由于存在着结构致密的毛细血管,所释放的酶大部分进入组织液。除一小部分通过毛细血管壁进入血液外,主要经由淋巴系统进入血液。由于血液只占细胞外液的20%,淋巴液和血液一天交换量可达50%-100%,其结果通过此途径进入血液的酶量不仅增高程度较低,在血中出现增高时间也较迟。临床医师不能忽视淋巴系统对血清酶浓度的影响。在一组动物实验中,单纯肌肉损伤加以固定,血中酶浓度变化不大;如加上被动运动,则AST明显升高;如移去实验动物胸导管,即使有被动运动,AST也不升高。
有作者认为在坏死病变时血中线粒体酶很少达到像胞质酶这样高的程度,也是因为坏死病灶无淋巴液或很少淋巴液流动,这样大量线粒体酶堆积在坏死区,只有少部分坏死边缘区酶通过淋巴进入血液。剧烈运动后血中酶升高与其说是由于细胞损伤引起,还不如说与酶在不同体液中重新分布有关。首先运动引起血压升高,血浆容量减少,血液浓缩;更重要的是运动加速了淋巴液回流入血,大量组织液中酶进入血液。因此即使细胞中酶无明显释放入血,血液酶浓度也可增高。
不同入血途径还可引起别一种差异,通过第三途径入血的往往是一些分子量小的单纯酶蛋白,通过前两种途径入血的不仅有单纯酶蛋白、大分子量的酶多聚体和抗体的复合物,乃至一些和细胞碎片结合的酶都易进入血液,临床上所观察的巨酶血症常与肝病有关,可能原因在此。
(三)血中酶的清除
为了很好解释临床上复杂情况,还必须了解不同酶从血中清除率的差异以及清除机制。弄清酶的清除率有助于理解,为什么同一疾病不同酶升高持续时间有差异。一般以血中酶的半寿期来代表酶从血中清除快慢,表7-2是一些常用酶的半寿期数据。
表7-2 血浆中酶的半寿期
| 酶 | 半寿期 |
| AST | 17±5h |
| ALT | 47±10h |
| GLD | 18±1h |
| LD1 | 113±60h |
| LD5 | 10±2h |
| CK | 约15h |
| CK-MM | 17±4h |
| Ck-MB | 12±4h |
| CK-BB | 约5h |
| ALP | 3-7天 |
| GGT | 3-4天 |
| CHE | 约10天 |
| AMY | 3-6h |
| LPS | 3-6h |
从表7-2中不难理解为什么在急性肝炎恢复期时AST先于ALT恢复正常,也很好解释在AMI时CK-MB持续时间最短,因其半寿期只有6小时,而LD1因其半寿期长达100余小时,持续时间最长。
有关酶从血中清除的机制,可说是目前最不清楚的问题,酶虽然也是蛋白质,但它们的半寿期明显比一般血清蛋白质为短,说明酶蛋白除遵守一般蛋白质代谢规律外,还有其特殊的清除机制。目前发现对于一小部分分子量小于60000的酶,如AMY可以从肾小球滤过一部分,从尿中排出,肾脏严重疾病时AMY升高也证实此一推论。但对于大多数酶而言,这种清除机制显然是不存在的。
过去曾强调,通过胆汁可能排泄一部分酶,并认为这是梗阻性黄疸时,血中ALP、亮氨酸氨基肽酶(LAP)的升高机制。而目前更多倾向认为此时升高机制是肝细胞受刺激合成更多的酶,因为如给以抑制蛋白合成的药物,虽有黄疸,这些酶也不升高。
目前有人强调单核吞噬细胞系统在清除酶中的作用,它们可将酶迅速吞噬入细胞中,并进一步分解破坏。有学者用Riley病毒选择性地感染小鼠单核吞噬细胞系统,引起血中LD、AST、AMY和CK等酶升高,用其它化合物封闭单核吞噬细胞系统也得类似结果。使用乙芪酚刺激单核吞噬细胞系统可加速这些酶的清除,但是也不能过高评价这种结果,就在同一试验中,一些酶如LD1和ALT就不受影响。此外,从临床角度来看,目前,尚无任何证据显示任何人的病毒感染疾病引起酶清除机制的障碍。
(四)酶合成异常
对于血浆特异酶,细胞内酶合成下降是引起血中酶变化的重要因素,这些酶大多在肝脏合成,因此当肝功能障碍时,胆碱酯酶常与白蛋白同时下降。酶合成减少和变异还见于不少遗传疾病,由于酶基因变异,可引起特定的酶合成减少乃至消失,如肝-豆状核综合征患者,血中铜氧化酶活性可明显下降乃至于零。在增生性疾病如骨骼疾病时,可因为骨细胞增生,合成分泌更多的ALP,引起血中此酶升高。恶性肿瘤患者血中酶升高有一部分可能与肿瘤细胞中酶合成增加有关,如前列腺癌细胞可产生大量酸性磷酸酶。
酶的诱导作用也可引起血中一些酶浓度增高,最明显例子是服用苯巴比妥后常可引起肝中GGT合成增加,血中浓度升高并不意味着肝细胞有什么病理变化,停药后GGT就会下降至正常。乙醇、巴比妥类、杜冷丁类以及双苯内酰脲类药物都有此种诱导作用,诱导的酶除GGT外还可以是ALP。
(五)其它
实验室所测到的酶活性浓度值主要和酶量多少相关,但还受到其它物质特别是抑制剂和活化剂的影响。在病理情况下,应考虑有无抑制作用,因为某些药物和毒物有抑制酶的作用。当使用某些药物治疗肝炎后,还应考虑此药物有无可能抑制ALT活性,此时血中ALT量不一定下降,只是活性受到抑制,使所测活性下降而已。有机磷中毒时所测的血清胆碱脂酶和红细胞中真性胆碱酯酶活性浓度可以很低,此时并不是酶含量降低,只是和有机磷结合,而有机磷是这些酶的不可逆抑制剂,使酶活性无法发挥。
| 关于“临床生物化学/血清酶变化的病理生理机制”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |