分泌蛋白
| A+医学百科 >> 分泌蛋白 |
分泌蛋白(secreted protein)
定义:是指在细胞内合成后,分泌到细胞外起作用的的蛋白质。例如:唾液淀粉酶,胃蛋白酶。注:例如呼吸酶就不属于分泌蛋白。
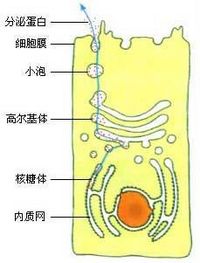
在核糖体上合成的分泌蛋白,要经过内质网和高尔基体,而不是直接运输到细胞膜。
进一步的研究表明,在核糖体上翻译出的蛋白质,进入内质网腔后,还要经过一些加工,如折叠、组装、加上一些糖基团等,才能成为比较成熟的蛋白质。然后,由内质网腔膨大、出芽形成具膜的小泡,包裹着蛋白质转移到高尔基体,把蛋白质输送到高尔基体腔内,做进一步的加工。接着,高尔基体边缘突起形成小泡,把蛋白质包裹在小泡里,运输到细胞膜,小泡与细胞膜融合,把蛋白质释放到细胞外。
组成生物体的蛋白质大多数是在细胞质中的核糖体上合成的,各种蛋白质合成之后要分别运送到细胞中的不同部位,以保证细胞生命活动的正常进行。有的蛋白质要通过内质网膜进入内质网腔内,成为分泌蛋白;有的蛋白质则需穿过各种细胞器的膜,进入细胞器内,构成细胞器蛋白。
(一)蛋白质的引导:
蛋白质的运输尽管比较复杂,但是生物系统中的蛋白质的运输可以用一个比较简单的模式来解释。每个需要运输的多肽都很有一段氨基酸序列,称为信号肽序列,引导多肽到不同的转运系统。
信号肽及其作用机制
70年代初期,许多研究发现,在编码分泌蛋白的基因中,许多基因的5'端都有一段DNA编码的15~35个氨基酸的疏水性肽片段,这一位于蛋白质N-—末端的肽段在成熟的分泌蛋白中并不存在,其功能在于引导随后产生的蛋白质多肽链穿过内质网膜进入腔内。这一段疏水性短肽在蛋白质的内质网——高尔基体——质膜分泌途径中具有重要作用,并被称之为信号肽。
1975年,布洛贝尔提出了信号肽假说。根据这一假说,在细胞质中,编码分泌蛋白的信使核糖核酸(mRNA)与游离的核糖体大小亚基结合而形成翻译复合体。从起始密码子开始,首先翻译产生信号肽,当转译进行到大约50~70个氨基酸之后,信号肽开始从核糖体的大亚基上露出,露出的信号肽立即被细胞质中的信号肽识别体(SRP)识别并与之相结合。此时,转译暂时停止,SRP牵引这条带核糖体的mRNA到达粗面内质网的表面,并与粗面内质网表面上的信号肽识别体受体(或称停泊蛋白)作用,这时,暂时被抑制的转译过程恢复进行,同时,内质网膜上某种特定的核糖体受体蛋白聚集,使膜双脂层产生孔道,带mRNA的核糖体与其受体蛋白结合,转译出的肽链便通过孔道进入内质网腔内。
信号肽在穿越膜后即被内质网腔内的信号肽酶水解切除。当核糖体与其受体蛋白结合后,SRP与停泊蛋白便解离,各自进入新的识别、结合循环。当转译进行到mRNA的终止密码子时,蛋白质的合成结束,核糖体的大小亚基解聚,大亚基与核糖体受体的相互作用消失,核糖体受体解聚,内质网膜上的蛋白孔道消失,内质网恢复成完整的脂双层结构。进入内质网腔内的多肽链在信号肽被水解切除后即进行折叠及其他一系列修饰过程,最终形成成熟的分泌蛋白。
(二)分泌蛋白在内质网(ER)内合成
在真核细胞中,内质网是最大的膜状结构的细胞器,其表面积可以是质膜面积的几倍。大部分的内质网与核糖体相结合形成糙面内质网,在糙面内质网上的核糖体是膜蛋白和分泌蛋白合成的地方,也是蛋白质分泌途径的起点 。多肽经移位后,在内质网的小腔中被修饰,通过短时间的加工后,分泌蛋白形成被膜包裹的小泡,转运到高尔基体,然后再转运到细胞表面或溶酶体。
1、蛋白质的修饰与加工
这些修饰包括糖基化、羟基化、酰基化、二硫键形成等,其中最主要的是糖基化,几乎所有内质网上合成的蛋白质最终被糖基化。糖基化的作用是: ①使蛋白质能够抵抗消化酶的作用;②赋予蛋白质传导信号的功能;③某些蛋白只有在糖基化之后才能正确折叠。
糖基化有两种类型:(1)糖蛋白是由寡糖连接在Asp的氨基的形成的,连接的链叫N-糖苷键。(2)寡糖连接在Ser、Thr或羟基-lys的羟基上(O-糖苷键)。N-糖苷键是在ER开始,而在高尔基体中进一步完成;O-糖苷键的形成仅发生在高尔基体中。
N-糖基化可分为3步,各种N-连接的寡糖都是在ER中开始加上的,途径也相同。一个寡糖含有2个N-乙酰-糖胺,9个苷露糖和3个葡萄糖,在一种特异的脂一多萜醇上形成,多萜醇磷酸酯即是携带糖的载体。多萜醇是一种高度疏水的酯,位于ER膜中,其活性基团面向着ER腔,寡糖是由单个的糖连接而构成,它通过焦磷酸和多萜醇连接。寡糖作为一个单位在与膜结合的糖基转移酶的作用下从多萜醇上转移到靶蛋白上。酶的活性位点也是露在ER腔中。受体基团是位于Asn-X-Ser或Asn-X-Thr(X是除Pro以外的任何氨基酸)中的Asn,当新生肽进入ER时,它一旦被识别后立即作为靶顺序暴露在腔中。有些寡糖的修整是在ER中进行,修整后再进入高尔基体。寡糖结构完成是分为两类,一类在转运到ER时,另一类是在越膜转运到高尔基体。究竟属于何种类型这要取决于苷露糖。苷露糖只是在ER中加上,随后可能还要被修整。在ER中被切去的单糖的数目是不同的。ER中的苷露糖苷酶很快地附着到第一个苷露糖上,附着下三个较慢。
高甘露糖寡聚糖含有的残基是在ER中加上的。寡糖加上后几乎立即又从蛋白上被切掉。3个葡萄糖残基被ER中的葡萄糖苷酶切除掉,ER中的甘露糖苷酶再从蛋白上切下2-4个甘露糖,在ER中产生3寡糖的最终结构。
2、新生肽链的折叠、组装,运输
在ER腔中折选和修饰是有关的,糖的连接对于正确的折叠是十分必要的。蛋白二硫异构酶可以改变二硫键,影响到折叠,它和特殊的ER蛋白的结合是必须的,此酶的某些活性或全部的活性可能是酶作为ER中的一种复合体的形式来实现的。即在越膜位点和蛋白结合才能发挥它的功能。
多肽经过内质网的加工、修饰、折叠后被膜包裹形成小泡转运到高尔基体在高尔基体进行进一步的加工。
(三)在高尔基体的进一步加工
高尔基体的主要有两方面的功能:一是对糖蛋白上的寡糖核作进一步的修饰与调整,二是将各种多肽进行分类并送往溶酶体、分泌粒和质膜的功能目的地。但蛋白质应送往哪里是由蛋白质本身的空间结构决定的。
高尔基体是由许多层袋状的膜结构组成的。糖蛋白的进一步糖基化修饰就是在这种膜结构中完成的,如复合寡聚糖就是在高尔基体中进一步修整和加上糖的残基。第一步是通过高尔基体的甘露糖苷酶Ⅰ修整甘露糖残基。然后单个的糖基由N-乙酰-葡萄糖胺转移加上,按着由高尔基体苷露糖苷酶Ⅱ继续切除苷露糖残基。
在高尔基体的修饰中都会产生内部核心,它是由NAc-Glc.NAc-GLc.Man3构成,最后要被剥去。末端区域加在内部核心下。末端区域的残基包括NAc-GLc,Gal和唾液酸(N-乙酰-神经氨[糖]酸。此加工的路径和糖基化是高度有序的,而且有两种类型的反应。一种糖残基的加入对于另一种糖基的剪切可能是必要的。如在最终剪除甘露糖之前要加上NAc-Glc。
现在还不知道加工过程中各种蛋白的降解,加工的模式及糖基化的信号是什么。据推测此信号在肽链的结构中,而不可能在寡糖中,因为N-糖苷键开始形成都是加上相同的寡糖。
经过高尔基体的进一步加工和分装,成熟的蛋白质通过小泡运到细胞表面或者是溶酶体。伴随各种具膜小泡的运输过程,细胞内形成了复杂的膜流,高尔基体在在膜流的调控中起枢纽的作用。
没有活性的前体蛋白,进行一个系列的翻译后加工后才能成为具有功能的成熟蛋白,各胞器之间有的明显分工但是个细胞器在分泌蛋白的形成和分泌过程中的又是相互联系密切相关的。
| 关于“分泌蛋白”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |