脂酶
| A+医学百科 >> 脂酶 |
脂酶,是一种催化脂类的酯键水解反应的水溶性酶。[1]因此,脂酶是酯酶下的一个亚类。
脂酶存在于基本上所有的生物体中,它在对脂类(如甘油三酸酯、脂肪、油等)的消化、运输和剪切中发挥着关键作用。编码脂酶的基因甚至也存在于某些病毒中。[2][3]
目录 |
功能
大多数脂酶作用于脂类分子的甘油骨架的特定位置。例如,人类胰脏脂酶(human pancreatic lipase)是人体消化系统中降解脂肪的主要酶,它就作用于食物油脂中的甘油三酸酯,将其转化为甘油单酯和脂肪酸。[4]
如果将磷脂酶[5]和神经磷脂酶(sphingomyelinase)[6]也考虑进来,则自然界中脂酶的作用将十分广泛。
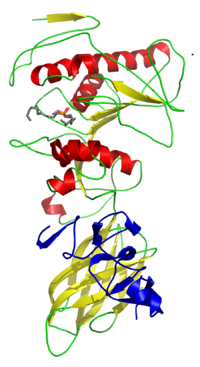
结构
自然界中存在大量遗传学上差异性大的脂酶,根据它们的折叠类型和催化机制可以分为多个类别。它们中的大多数采取α/β水解酶折叠[7][8][9][10]和胰凝乳蛋白酶类似的水解机制(活性位点包括丝氨酸亲核基团、一个酸性残基和一个组氨酸)[11][12]。许多革兰氏阴性菌产生的脂酶需要一个辅助蛋白(脂酶特异性折叠酶)来帮助它们正确折叠形成有生物活性的构象。
生理学分布
脂酶参与了各种不同的生命进程,从脂类代谢到信号转导[13]和炎症反应[14]。因此,一些脂酶的活性被限制在特定的细胞区室中或在细胞外部。
- 溶酶体脂酶被限制在细胞器溶酶体中;
- 一些脂酶,如胰脏脂酶,被分泌到细胞外去降解脂类,而降解产物可以更容易被机体所吸收;
- 真菌和细菌可以分泌脂酶来帮助对外部营养物的吸收;
- 一些蜂毒中含有磷脂酶,可以加强蜂叮后的损伤和炎症反应。
人体中的脂酶
人体消化系统中主要的脂酶是由胰脏所分泌的人类胰脏脂酶和胰脏脂酶相关蛋白2(pancreatic lipase related protein 2,PLRP2)。除此之外,人体中还有其他一些脂酶,包括肝脂酶(hepatic lipase)、内皮脂酶(endothelial lipase)和脂蛋白酯酶(lipoprotein lipase)。并非所有的酯酶都在消化道中发挥作用(见下表)。
| 名称 | 基因 | 定位 | 描述 | 异常症 |
| 胰脏脂酶 | PNLIP | 消化液 | 为了在肠腔中发挥最佳活性,胰脏脂酶需要另一个同样是由胰脏分泌的蛋白质,辅脂酶(colipase)的帮助。[15] | 如果胰脏脂酶的水平过高会引发胰腺炎,并可能导致胰脏功能丧失。 |
| 溶酶体脂酶 | LIPA | 溶酶体内部 | 也被称为溶酶体酸脂酶(lysosomal acid lipase)或酸性胆固醇酯水解酶(acid cholesteryl ester hydrolase) | 编码该酶的基因突变能够导致胆固醇酯沉积病(Cholesteryl ester storage disease)和Wolman氏病[16] |
| 肝脂酶 | LIPC | 內皮細胞 | 肝脂酶作用于血液中脂蛋白携带的脂类,并生成低密度脂蛋白(low density lipoprotein)。 | - |
| 脂蛋白酯酶 | LPL或LIPD | 內皮細胞 | 脂蛋白酯酶作用于血液中极低密度脂蛋白(very low density lipoprotein)携带的甘油三酸酯,使得细胞可以摄入反应释放出的脂肪酸。 | 编码该酶的基因出现突变可以导致脂蛋白脂酶缺陷(Lipoprotein lipase deficiency)[17][18] |
| 激素敏感脂酶 | LIPE | 细胞内部 | - | - |
| 胃脂酶 | LIPF | 消化液 | 在接近中性pH的情况下,在婴儿体内帮助消化脂类 | - |
| 内皮脂酶 | LIPG | 內皮細胞 | - | - |
| 胰脏脂酶相关蛋白2(PLRP2) | PNLIPRP2或PLRP2 | 消化液 | - | - |
| 胰脏脂酶相关蛋白1(PLRP1) | PNLIPRP1或PLRP1 | 消化液 | 该酶与胰脏脂酶以及PLRP2在氨基酸序列上非常相似(这三中酶的基因可能是从单一的原始基因通过基因重复而产生)。但PLRP1的功能未知,虽然它在其他哺乳动物体内也很保守。[19][20] | - |
| 舌脂酶 | ? | 消化液 | - | - |
其他脂酶还包括LIPH、LIPI、LIPJ、LIPK、LIPM、LIPN、MGLL、DAGLA、DAGLB和CEL.
此外,还有许多磷脂酶,但有些磷脂酶并不是总是被归类为脂酶。
用途
早在古代,真菌和细菌中的脂酶就已经在酸奶和奶酪的发酵过程中发挥作用。在现代社会中,脂酶则作为便宜而又多用途的降解脂类的高效催化剂而得以广泛使用。例如,一家生物技术公司推出重组的脂酶,其可用于洗涤剂甚至作为制造可替代能源(将植物油转化为燃料)中的催化剂。[21][22][23]
参考文献
- ↑ Svendsen A. Lipase protein engineering. Biochim Biophys Acta. 2000, 1543 (2): 223–228. PMID 11150608.
- ↑ Afonso C, Tulman E, Lu Z, Oma E, Kutish G, Rock D. The genome of Melanoplus sanguinipes entomopoxvirus. J Virol. 1999, 73 (1): 533–52. PMID 9847359.
- ↑ Girod A, Wobus C, Zádori Z, Ried M, Leike K, Tijssen P, Kleinschmidt J, Hallek M. The VP1 capsid protein of adeno-associated virus type 2 is carrying a phospholipase A2 domain required for virus infectivity. J Gen Virol. 2002, 83 (Pt 5): 973–8. PMID 11961250.
- ↑ Winkler FK, D'Arcy A, and W Hunziker. Structure of human pancreatic lipase. Nature. 1990, 343 (6260): 771–774. doi:10.1038/343771a0. PMID 2106079.
- ↑ Diaz, B.L., and J. P. Arm.. Phospholipase A(2). Prostaglandins Leukot Essent Fatty Acids. 2003, 2-3: 87–97. doi:10.1016/S0952-3278(03)00069-3. PMID 12895591.
- ↑ Goñi F, Alonso A. Sphingomyelinases: enzymology and membrane activity. FEBS Lett. 2002, 531 (1): 38–46. doi:10.1016/S0014-5793(02)03482-8. PMID 12401200.
- ↑ Schrag J, Cygler M. Lipases and alpha/beta hydrolase fold. Methods Enzymol. 1997, 284: 85–107. doi:10.1016/S0076-6879(97)84006-2. PMID 9379946.
- ↑ Winkler FK, D'Arcy A, and W Hunziker. Structure of human pancreatic lipase. Nature. 1990, 343 (6260): 771–774. doi:10.1038/343771a0. PMID 2106079.
- ↑ Egmond, M. R., and C. J. van Bemmel. Impact of Structural Information on Understanding of Lipolytic Function. Methods Enzymol. 1997, 284: 119–129. doi:10.1016/S0076-6879(97)84008-6. PMID 9379930.
- ↑ Withers-Martinez C, Carriere F, Verger R, Bourgeois D, and C Cambillau. A pancreatic lipase with a phospholipase A1 activity: crystal structure of a chimeric pancreatic lipase-related protein 2 from guinea pig. Structure. 1996, 4 (11): 1363–74. doi:10.1016/S0969-2126(96)00143-8. PMID 8939760.
- ↑ Brady, L., A. M. Brzozowski, Z. S. Derewenda, E. Dodson, G. Dodson, S. Tolley, J. P. Turkenburg, L. Christiansen, B. Huge-Jensen, L. Norskov, and et al.. A serine protease triad forms the catalytic centre of a triacylglycerol lipase. Nature. 1990, 343 (6260): 767–70. doi:10.1038/343767a0. PMID 2304552.
- ↑ Lowe ME. The catalytic site residues and interfacial binding of human pancreatic lipase. J Biol Chem. 1992, 267 (24): 17069–73. PMID 1512245.
- ↑ Spiegel S, Foster D, and R Kolesnick. Signal transduction through lipid second messengers. Curr Opin Cell Biol. 1996, 8 (2): 159–67. doi:10.1016/S0955-0674(96)80061-5. PMID 8791422.
- ↑ Tjoelker LW, Eberhardt C, Unger J, Trong HL, Zimmerman GA, McIntyre TM, Stafforini DM, Prescott SM, and PW Gray. Plasma platelet-activating factor acetylhydrolase is a secreted phospholipase A2 with a catalytic triad. J Biol Chem. 1995, 270 (43): 25481–7. doi:10.1074/jbc.270.43.25481. PMID 7592717.
- ↑ Lowe ME. The triglyceride lipases of the pancreas. J Lipid Res. 2002, 43 (12): 2007–16. doi:10.1194/jlr.R200012-JLR200. PMID 12454260.
- ↑ Omim - Wolman Disease
- ↑ Familial lipoprotein lipase deficiency - Genetics Home Reference
- ↑ Gilbert B, Rouis M, Griglio S, de Lumley L, Laplaud P. Lipoprotein lipase (LPL) deficiency: a new patient homozygote for the preponderant mutation Gly188Glu in the human LPL gene and review of reported mutations: 75 % are clustered in exons 5 and 6. Ann Genet, 44 (1): 25–32. PMID 11334614.
- ↑ Crenon I, Foglizzo E, Kerfelec B, Verine A, Pignol D, Hermoso J, Bonicel J, Chapus C. Pancreatic lipase-related protein type I: a specialized lipase or an inactive enzyme. Protein Eng. 1998, 11 (2): 135–42. doi:10.1093/protein/11.2.135. PMID 9605548.
- ↑ De Caro J, Carriere F, Barboni P, Giller T, Verger R, De Caro A. Pancreatic lipase-related protein 1 (PLRP1) is present in the pancreatic juice of several species. Biochim Biophys Acta. 1998, 1387 (1-2): 331–41. PMID 9748646.
- ↑ Guo Z, Xu X. New opportunity for enzymatic modification of fats and oils with industrial potentials. Org Biomol Chem. 2005, 3 (14): 2615–9. doi:10.1039/b506763d. PMID 15999195.
- ↑ Gupta R, Gupta N, Rathi P. Bacterial lipases: an overview of production, purification and biochemical properties. Appl Microbiol Biotechnol. 2004, 64 (6): 763–81. doi:10.1007/s00253-004-1568-8. PMID 14966663.
- ↑ Ban K, Kaieda M, Matsumoto T, Kondo A, Fukuda H. Whole cell biocatalyst for biodiesel fuel production utilizing Rhizopus oryzae cells immobilized within biomass support particles. Biochem Eng J. 2001, 8 (1): 39–43. doi:10.1016/S1369-703X(00)00133-9. PMID 11356369.
参见
外部链接
参考来源
| 关于“脂酶”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |