生理学/骨骼肌的收缩机制和兴奋-收缩耦联
| 医学电子书 >> 《生理学》 >> 细胞的基本功能 >> 肌细胞的收缩功能 >> 骨骼肌的收缩机制和兴奋-收缩耦联 |
| 生理学 |
|
|
|
Huxley等在50年代初期就提出了用肌小节中粗、细肌丝的相互滑行来说明肌肉收缩的机制。这一被称为滑行理论(sliding theory)的主要内容是:肌肉收缩时虽然在外观上可以看到整个肌肉或肌纤维的缩短,但在肌细胞内并无肌丝或它们所含的分子结构的缩短,而只是在每一个肌小节内发生了细肌丝向粗肌比之间的滑行,亦即由z线发出的细肌丝在某种力量的作用下主动向暗带中央移动,结果各相邻的z线都互相靠近,肌小节长度变短,造成整个肌原纤维、肌细胞乃至整条肌肉长度的缩短。滑行现象最直接的证明是,肌肉收缩时并无暗带长度的变化,而只能看到明带长度的缩短;并且与此同时也看到暗带中央H带相应地变窄。这只能说明,细肌丝在肌肉收缩时也没有缩短,只是它们更向暗带中央移动,和粗肌丝发生了更大程度的重叠。这种变化只能用粗、细肌丝之间出现了相对运动即滑行现象来解释。滑行理论需要进一步说明的问题是:肌肉收缩时究竟是什么力量促使细肌丝向粗肌丝之间滑行,以及怎样把这些过程和肌肉膜的兴奋过程联系起来。近年来,由于肌肉生物化学及其他细胞生物学技术的发展,肌丝滑行的机制已基本上从组成肌丝的蛋白质分子结构的水平得到阐明,对于与滑行的开始和终止有关的各种控制因素,也有了较较深入的了解。
(一)肌丝的分子组成和横桥的运动
滑行现象的引起与组成肌丝的蛋白质分子结构和它们的特性有直接的关系。粗肌丝主要由肌凝蛋白(亦称肌球蛋白)所组成,它们的分子在粗肌丝中呈独特的有规则的排列。一条粗肌丝大约含有200~300个肌凝蛋白分子,每个分子长150nm,呈长杆状而在一端有球状膨大部。在组成粗肌丝时,各杆状部朝向M线而聚合成束,形成粗肌丝的主干,球状部则有规则地裸露在M线两侧的粗肌丝主干的表面,形成横桥(图2-21,左)。当肌肉安静时,横桥与主干的方向相垂直,由粗肌丝表面突出约6nm。用X-线衍射法证明,横桥在粗肌丝表面的分布位置也是严格有规则的,即在粗肌丝的同一周径上只能有两个相隔180°的横桥突出;在与此周径相隔14.3nm的主干上又有一对横桥突出,但与前一对有60°的夹角;如此反复,到第四对横桥出现时,其方向正好与第一对横桥相平行,且与第一对横桥相隔42.9nm(图示-21,右)。上述横桥的分布情况,正好与一条粗肌丝为6条细肌丝所环绕的情况相对应,亦即在所有横桥出现的位置,正好有一条细肌丝与之相对;而对于每条细肌丝来说,粗肌丝表面每隔42.9nm就伸出一个横桥与之相对(图2-21)。这种对应关系,对于粗、细肌丝之间的相互作用显然是十分有利的。
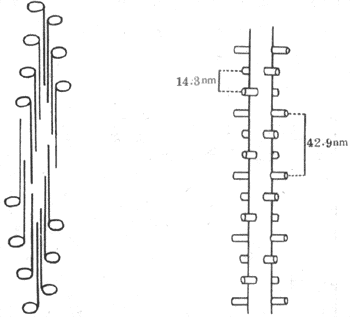
图2-21 粗肌丝中肌凝蛋白分子的排列示意图
左、肌凝蛋白分子的长杆状部横向聚合,形成粗肌丝主干,球状部裸露在表面,形成横桥
右、横桥在粗肌丝表面的几何排列
现已证明,横桥所具有的生物化学特性对于肌丝的滑行有重要意义。横桥的主要特性有二:一是横桥在一定条件下可以和细肌丝上的肌纤蛋白分子呈可逆性的结合,同时出现横桥向M线方向的扭动,继而出现横桥和细肌丝的解离、复位,然后再同细肌丝上另外的点结合,出现新的扭动,如此反复,使细肌丝继续向M线方向移动;二是横桥具有ATP酶的作用,可以分解ATP而获得能量,作为横桥摆动和作功的能量来源。由此可见,横桥和细肌丝的相互作用,是引起肌丝滑行的必要条件。
细肌丝至少由三种蛋白质组成,其中60%是肌纤蛋白(亦称肌动蛋白)。肌纤蛋白与肌丝滑行有直接的关系,故和肌凝蛋白一同被称为收缩蛋白质。肌纤蛋白分子单体呈球状,但它们在细肌丝中聚合成双螺旋状,成为细肌丝的主干(图2-22)。细肌丝中另外有两种蛋白质,它们不直接参与肌丝间的相互作用,但可影响和控制收缩蛋白质之间的相互作用,故称为调节蛋白质;其中一种是原肌凝蛋白,也呈双螺旋结构,在细肌丝中和肌纤蛋白双螺旋并行,但在肌肉安静时原肌凝蛋白的位置正好在肌纤蛋白和横桥之间(图2-23,左)这就起了阻碍两者相互结合的作用;另一种调节蛋白质称为肌钙蛋白(亦称原宁蛋白),肌钙蛋白在细肌丝上不直接和肌纤蛋白分子相连接,而只是以一定的间隔出现在原肌凝蛋白的双螺旋结构之上。肌钙蛋白的分子呈球形,含有三个亚单位(图2-22):亚单位C中有一些带双负电荷的结合位点,因而对肌浆中出现的Ca2+(以及其他可能出现的两价正离子和H+)有很大的亲和力;亚单位T作用是把整个肌钙蛋白分子结合于原肌凝蛋白;而亚单位I的作用是在亚单位C与Ca2+结合时,把信息传递给原肌凝蛋白,引起后者的分子构象发生改变,解除它对肌纤蛋白和横桥相互结合的阻碍作用。
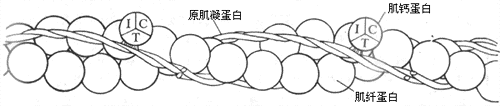
图 2-22 细肌丝的分子组成
I、T、C分别代表肌钙蛋白的三个亚单位
肌丝滑行的基本过程一般公认为:当肌细胞上的动作电位引起肌浆中Ca2+浓度升高时,作为Ca2+受体的肌钙蛋白结合了足够数量的Ca2+,这就引起了肌钙蛋白分子构象的某些改变,这种改变“传递”给了原肌凝蛋白,使后者的构象也发生某些改变,其结果是使原肌凝蛋白的双螺旋结构发生了某种扭转,这就把安静时阻止肌纤蛋白和横桥相互结合的阻碍因素除去,出现了两者的结合。在横桥与肌纤蛋白的结合、扭动、解离和再结合、再扭动构成的横桥循环过程中,使细肌丝不断向暗带中央移动;与此相伴随的是ATP的分解消耗和化学能向机械能的转换,完成了肌肉的收缩(图示2-23)。
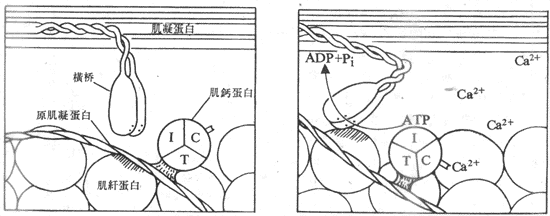
图2-23 Ca2+通过和肌钙蛋白的结合,诱发横桥和肌纤蛋白之间的相互作用
上述的横桥循环在一个肌小节以至整个肌肉中都是非同步地进行的,这样才可能使肌肉产生恒定的张力和连续的缩短。至于能参与循环的横桥数目以及横桥循环的进行速率,则是决定肌肉缩短程度、缩短速度以及所产生张力的关键因素,这将在分析肌肉收缩的力学表现时再作讨论。下面叙述正常条件下引发和终止横桥循环的肌浆中Ca2+浓度的突然升高和快速下降是怎样发生的。
(二)骨骼肌的兴奋-收缩耦联
在整体情况下,骨骼肌总是在支配它的躯体传出神经的兴奋冲动的影响下进行收缩的;直接用人工刺激作用无神经支配的骨骼肌,也可引起收缩。但不论何种情况,刺激在引起收缩之前,都是先在肌细胞膜上引起一个可传导的动作电位,然后才出现肌细胞的收缩反应。这样,在以膜的电变化为特征的兴奋过程和以肌丝的滑行为基础的收缩过程之间,必然存在着某种中介性过程把两者联系起来,这一过程,称为兴奋-收缩耦联。目前认为,它至少包括三个主要步骤:电兴奋通过横管系统传向肌细胞的深处;三联管结构处的信息传递;肌浆网(即纵管系统)对Ca2+释放和再聚积。
横管系统对正常肌细胞的兴奋-收缩耦联是十分必要的。用含有甘油的高渗任氏液浸泡肌肉一段时间,再把它放回到一般任氏液中,这样的处理可以选择性地破坏肌细胞的横管系统;这时如果再给肌肉以外加刺激,虽然仍可在完好的肌细胞膜上引起动作电位,但不再能引起细胞收缩。近年来证明,横管膜和一般肌细胞膜有类似的特性,又是后者的延续部分,因而它也可以产生以Na+内流为基础的膜的去极化甚或动作电位;当一般细胞膜因兴奋而产生动作电位时,这一电变化可沿着凹入细胞内部的横管膜传导,深入到三联管结构和每个肌小节的近旁。
实际测定还证明,肌肉安静时肌浆中的Ca2+浓度低于10-7mol/L,但在膜开始去极化的很短时间内,可以在1~5ms内升高到10-5mol/L的水平,亦即增高100倍之多。这样多的Ca2+由何而来?用放射性45Ca自显影等技术证明,肌肉安静时Ca2+主要停留和聚积在z线附近,相当于肌浆网的终末池部位;肌肉收缩时,Ca2+由这里向暗带区扩散,触发横桥循环。这样问题就归结为:当肌膜上的电变化沿横管系统到达三联管部分时,一定有某种因子把横管膜上发生的变化传递给了相距不远的肌浆网膜上的类似Ca2+通道的结构,引起后者分子的变构作用,使通道开放,于是肌浆网内高浓度的Ca2+就不需耗能而靠易化扩散进入肌浆,到达肌丝区。传递这一信号的因子,有人认为是横管膜上存在的一种特殊蛋白,平时对肌浆网Ca2+通道外侧开口有机械堵塞作用,但在横管膜有电变化时发生变构作用,使原来的堵塞作用解除;也有人认为横管膜可因电变化而产生了第二信使类物质IP3(见本章第二节),由后者作用于Ca2+通道使之开放。由于三联管外有关的膜和膜中蛋白质几乎可以相互接触,因而第一种控制形式还是有可能的。
释放到肌浆中的Ca2+怎样被迅速除去,目前已证明是由于肌浆网膜结构中存在的一种特殊的离子转运蛋白质即钙泵活动的结果。钙泵是一种Ca2+依赖式ATP酶,目前已被分离提纯,它占肌浆网膜蛋白质总量的60%;在肌浆中Ca2+增高情况上,它可以分解ATP获得能量,将Ca2+在逆浓度差的情况下由肌浆转运到肌浆网内腔中去;由于肌浆中Ca2+浓度的降低,和肌钙蛋白结合的Ca2+也解离,引起肌肉舒张。
| 关于“生理学/骨骼肌的收缩机制和兴奋-收缩耦联”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |