医用化学/强电解质在溶液中的离解
| 医学电子书 >> 《医用化学》 >> 电解质溶液 >> 电解质在溶液中的离解 >> 强电解质在溶液中的离解 |
| 医用化学 |
|
|
|
(一)离子互吸学说
稀释定律适用于弱电解质溶液,而不适用于强电解质溶液。为了阐明强电解质在溶液中的实际情况,德拜(Debye)和休克尔(Huckel)提出了离子互吸学说,又叫完全电离学说。这种学说认为,强电解质在水溶液中完全离解成离子,离子在水溶液中并不完全自由。带异号电荷的离子相互吸引,距离近的吸引力大;带同号电荷的离子相互排斥,距离近的排斥力大。因此,离阳离子越近的地方,阳离子越少,阴离子越多;离阴离子越近的地方,阴离子越少,阳离子越多。总的结果是,任何一个离子都好像被一层球形对称的异号电荷离子所包围着。这层在中心阳离子周围所构成的球体,叫做离子氛。如图2-1所示,位于球体中心的离子称为中心离子,在中心阳离子周围有阴离子氛,在中心阴离子周围有阳离子氛。
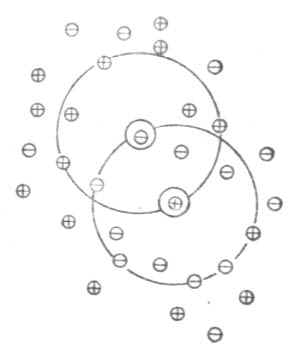
图2-1 离子氛示意图
在离子氛的影响下,溶液中的离子受到带有相反电离子荷氛的影响,而不能完全自由活动。使强电解质溶液中的离子不能百分之百地发挥应有的效能。因此,实测的离解度总是小于100%,这不是强电解质的真实离解度,它反映了溶液中离子间相互影响的程度,我们把这种离解度称为“表现离解度”。而强电解质的真实离解度是100%。
后来发现在强电解质溶液中,不但有离子氛存在,而且相反电荷的离子还可以缔合成离子对作为一个独立单位而运动。有的离子对没有导电能力。离子对在遇到强力碰撞时,可以分开,随后又可以重新形成新的离子时对。离子对的存在也使自由离子的浓度下降,导致溶液的导电能力下降。
离子氛和离子对的形成显然与溶液的浓度和离子电荷有关。溶液愈浓,离子所带的电荷愈多,上述效应愈显著。
如取不同浓度的KCL溶液,测定它的离解度(α)值,根据稀释定律求得相就的“离解常数”值如表2-3。
表2-3 18℃,不同浓度KCL溶液的“离解度”和“离解常数”
| 浓度/mol.L-1 | 离解度/% | 离解常数 |
| 0.01 | 94.2 | 0.152 |
| 0.1 | 86.2 | 0.536 |
| 1.0 | 75.6 | 2.34 |
| 2.0 | 71.2 | 3.52 |
由表2-3可以看出,强电解质”离解常数”K随溶液浓度的不同变化很大,这说明强电解质不存在离解常数.也就是说强电解质在溶液中是完全离解的,不存在离解平衡,因而就不存在离解度和离解常数.稀释定律是以弱电解质的可逆性过程为基础推导得出的,所以它不适用于强电解质溶液,不能客观地阐明强电解质在溶液中的实际情况.
(二)离子活动和活度系数
由于强电解质溶液中存在离子氛和离子对,每个离子不能完全自由地发挥它在导电等方面的作用,路易斯(Lewis)就提出了活度的概念.离子活度是溶液中离子的有效浓度.它等离子和活度系数的乘积.设离子的浓度为c,活度系数为f,则离子的活度(α)为:α=fc (2-5) 或f=α/c
活度系数f反映了离子间存在着相互影响这一因素.由于离子的活度一般都比浓度小,所以f一般都小于1.活度系数大,表示离子牵制作用弱,离子活动的自由程度大.溶液愈稀,活度系数愈接近于1.当溶液无限稀释时,活度系数等于1,这时离子的运动完全自由,离子活动就等于离子浓度.
因为电解质溶液中必定同时存在阳离子和阴离子,实验无法独测出阳离子的活度系数或阴离子的活度系数.但实验可以测出一个电解质的阳/阴离子的平均活度系数(f±).强电解质溶液的活度一般指溶液的平均活度(α±)
α±= f±×c
表2-4列举了25℃时,一些强电解质的离子平均活度系数.
表2-4 一些强电解质的离子平均活度系数(25℃)
| 电解质 | C/mol.L-1 | ||||||
| 0.001 | 0.005 | 0.01 | 0.05 | 0.1 | 0.5 | 1.0 | |
| HCL | 0.966 | 0.928 | 0.904 | 0.803 | 0.796 | 0.758 | 0.809 |
| KOH | 0.96 | 0.92 | 0.90 | 0.82 | 0.80 | 0.73 | 0.76 |
| KCL | 0.965 | 0.927 | 0.901 | 0.815 | 0.769 | 0.651 | 0.606 |
| H2SO4 | 0.630 | 0.639 | 0.544 | 0.340 | 0.265 | 0.154 | 0.130 |
| Ca(NO3)2 | 0.88 | 0.77 | 0.71 | 0.54 | 0.48 | 0.38 | 0.35 |
| CuSO4 | 0.74 | 0.53 | 0.41 | 0.21 | 0.16 | 0.068 | 0.047 |
例3 已知25℃时,0.1mol.L-1KCL溶液中,离子的平均活度系数为0.769,求离子的平均活度.
解:已知f±=0.769 c=0.1 mol.L-1
α±=0.769×0.1=0.0769×mol.L-1
(三)离子强度
溶液中离子的活度系数不仅与它的浓度有关,并且还与溶液中其它各种离子的总浓度和离子的电荷数有关,但与离子的种类无关.因此,溶液中离子的浓度和离子的电荷数就成为影响离子活度系数的主要因素.为了阐明离子浓度和离子电荷数对离子活度的影响,引入了离子度的概念.离子强度表示溶液中离子所产生的电场强度.它是溶液中各种离子的量浓度乘以离子电荷数的平方总和的二分
![]() (2-6)
(2-6)
式中,I代表溶液的离子浓度;c是离子的量浓度;z是离子的电荷数.
例4 求0.01mol.L-1NaCL溶液的离子强度.
解:I=1/2×(0.01×12+0.01×12)=0.01
例5 溶液中含有0.05mol.L-1NaCL和0.01 mol.L-1KCL,求该溶液的离子强度.
解:I=1/2×(0.05×12+0.05×12+0.01×12+0.01×12)=0.06
离子活度系数随溶液中离子强度的改变而显著改变,表2-5列出了离子强度和平均活度系数的关系.溶液中离子强度越大,离子间的相互影响越强,离子活动受到的限制就越大。只有当溶液接近于无限稀释时,离子强度趋近于零,离子才能完全自由活动,这时离子的活度生活费数就接近于1,即离子活度就接近于离子的真实浓度。
表2-5 不同离子强度时离子的活度系数(25℃)
| 活度系数 离子强度 |
电 荷 数 | |||
| 1 | 2 | 3 | 4 | |
| 1×10-4 | 0.99 | 0.95 | 0.90 | 0.83 |
| 2×10-4 | 0.98 | 0.94 | 0.87 | 0.770.77 |
| 5×10-4 | 0.97 | 0.90 | 0.80 | 0.67 |
| 1×10-3 | 0.96 | 0.86 | 0.73 | 0.56 |
| 2×10-3 | 0.95 | 0.81 | 0.64 | 0.45 |
| 5×10-3 | 0.92 | 0.72 | 0.51 | 0.30 |
| 1×10-2 | 0.89 | 0.63 | 0.39 | 0.19 |
| 2×10-2 | 0.87 | 0.57 | 0.28 | 0.12 |
| 5×10-2 | 0.81 | 0.44 | 0.15 | 0.04 |
| 0.1 | 0.78 | 0.33 | 0.08 | 0.01 |
| 0.2 | 0.70 | 0.24 | 0.04 | 0.003 |
| 0.3 | 0.66 | 0.62 | - | - |
| 0.5 | 0.62 | - | - | - |
采用离子强度的目的,是因为离子的活度系数的测定方法一般比较复杂,不容易测定。但是,离子活度系数与离子强度间却存在着一定的联系,并且离子强度很容易由离子的浓度与其所带电荷而求得。在测定离解迷路数时等精密工作中,要求对离子的有效浓度作精确计算,这就需要由离子将浓度换算成活度。但在一般有关稀溶液的计算中,可直接换算成活度。
| 关于“医用化学/强电解质在溶液中的离解”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |