跨膜蛋白
| A+医学百科 >> 跨膜蛋白 |
跨膜蛋白(transmembrane protein,TP)是一种贯穿生物膜两端的蛋白。许多跨膜蛋白的功能是作为通道或“装载码头”来实施拒绝或允许某种特定的物质跨过生物膜的运输、进入细胞,同时,也使要废弃的副产品运出细胞。当对某种分子做出相应时,这些“负责运载”的跨膜蛋白通过特定的折叠和弯曲方式,实现该分子的跨过生物膜的运输。
“跨膜蛋白”是一种跨越整个生物膜一次或多次的蛋白。跨膜蛋白在水中凝聚并沉淀。大多数跨膜蛋白要用去污剂或非极性溶剂提取,少数贝塔-折筒状蛋白也可以用某些变性剂提取。
浅棕色部分代表膜
所有的跨膜蛋白是整合膜蛋白(也叫内嵌膜蛋白),但是不是所有的整合膜蛋白都是跨膜蛋白。[1]
目录 |
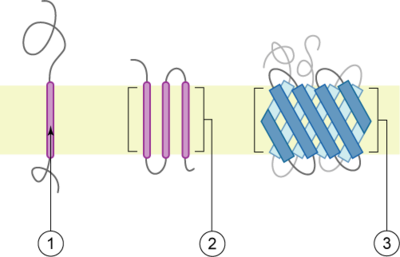
类型
跨膜蛋白有两种基本类型:[2]
- α-螺旋:这种蛋白存在于细菌细胞的内膜或真核细胞的质膜,也有时存在于真核细胞的外膜。[3]这是跨膜蛋白的主要类型。据估计在人体内所有蛋白质的27%是α-螺旋膜蛋白。[4]
- β-筒状蛋白。到目前为止,这类蛋白仅在革兰氏阴性细菌的外膜、革兰氏阳性细菌的细胞壁、以及线粒体和染色质的外膜上发现。所有的β-筒状跨膜蛋白都有最简单的上-和-下拓扑学结构,这可以反映出他们共同的进化起源和相似的折叠机制。另一种分类是根据其N- 和C-末端结构域的位置。I、II、III型为一次跨膜蛋白,而IV型是多次跨膜蛋白。I型跨膜蛋白用停止-传输锚定序列锚定到脂质膜上,并且,其N-末端结构域在合成时瞄准于ER腔(内质网腔,并且,如果成熟形式是位于质膜上,则N-末端结构域则瞄准于细胞外间隙。II型和III型用信号锚定序列锚定。II型用其C-末端结构域瞄准ER腔,而III型有其N-末端结构域瞄准ER腔。IV型有两个亚型-IV-A和IV-b。IV-A用其N-末端结构域瞄准细胞质,而IV-B则用其N-末端瞄准腔。[5]划分成四种类型的意义特别显示于转运和内质网束缚的翻译时。此时,蛋白必须根据类型决定其通过内质网膜的方向。
热力学稳定性和折叠
α-螺旋跨膜蛋白的稳定性
从热变性研究判定α-螺旋跨膜蛋白通常是稳定的,因为在膜内它们不完全解折叠(在非极性介质中的完全展开需要断裂太多的α-螺旋H-键)。另一方面,这些蛋白很容易“错折叠”,因为在膜中的非天然聚集转化成熔球态,形成非天然的双硫键,或者外周区域和不规则环的解折叠,这些解使局部稳定性降低。。
恰当地定义“解折叠态”也很重要。在去污剂胶束中的膜蛋白的“解折叠态”不同于热变性实验中的“解折叠态”。在去污剂中的状态代表了折叠的疏水α-螺旋和去污剂覆蓋的部分解折叠片段。例如,在十二烷基磺酸钠(SDS)胶束中的“解折叠”的细菌视紫红质有四个折叠的跨膜α-螺旋,而其余的蛋白则位于胶束-水界面并且可取不同的非天然的两性分子的结构类型。在这样的去污剂失活的和天然态之间的自由能差相似于水溶性蛋白的稳定性(< 10 kcal/mol)。
α-螺旋跨膜蛋白的折叠
α-螺旋跨膜蛋白在体外(in vitro)的再折叠在技术上是困难的。有相对较少的成功再折叠实验的例子,比如像对细菌视紫红质的实验。在体内(in vivo)通常所有这样的蛋白是在大的膜易位子(translocon)中翻译折叠的。易位子通道对新生的跨膜α-螺旋提供了一种高度异质的环境。相对极性的两性α-螺旋可以接受在易位子中的跨膜定向(尽管它可能是在膜表面或“在体外”解折叠),因为它的极性残基可以面对中心充水的易位子通道。这样的机制对于将极性的α-螺旋结合到跨膜蛋白的结构中是必需的。如果蛋白保持解折叠和附着在易位子上的时间太长,它会被专门的“质量控制”细胞体系所降解。
β-筒状蛋白的稳定性和折叠
根据化学变性研究,β-筒状蛋白的稳定性与水溶性蛋白的稳定性相似。它们“在体内”的折叠被水溶性分子伴侣如,蛋白Skp[1]所易化。
三维(3D)结构
光吸收驱动的转运蛋白
氧化还原驱动的转运蛋白
- 跨膜细胞色素b样蛋白[9]:辅酶Q-细胞色素c还原酶(细胞色素bc1);细胞色素b6f复合物;甲酸脱氢酶、呼吸硝酸还原酶;琥珀酸-辅酶Q还原酶(延胡索酸还原酶);和琥珀酸脱氢酶。见电子传输链。
- 来自细菌和线粒体的细胞色素c氧化酶[10]
电化学势驱动的转运蛋白
- 质子或钠易位F-型和V-型ATP酶[2]
P-P-键水解驱动的转运蛋白
- P-型钙ATP酶(5种构象)[3]
- 钙ATP酶调控子受磷蛋白和肌脂蛋白[4]
- ABC转运蛋白:BtuCD, multidrug transporter, and molybdate uptake transporter
- 普通次级途径(Sec)易位子(前蛋白转位酶SecY)[5]
转运子(单一转运子,协同转运子,反向转运子)
- 线粒体运载蛋白[6]
- 主要的易化因子超家族(Major Facilitator Superfamily,甘油-3-磷酸转运子、乳糖透性酶、和多药转运子(Multidrug transporter EmrD)[7]
- 耐药节结化细胞分化家族(Resistance-nodulation-cell division family,多药外排转运子AcrB,见多药耐药)[8]
- 二羧酸/氨基酸:阳离子协同转运子(质子谷氨酸协同转运子)[9]
- 单价阳离子/质子反向转运子(钠/质子反向转运子1 NhaA) [10]
- 神经递质钠协同转运子[11]
- 氨转运子[12]
- 药物/代谢转运子(小型多药抗药转运子EmrE-结构回收错误)[13]
阿拉发-螺旋通道包括离子通道
- 电压门离子通道如:包括钾通道KcsA和KvAP,和内向整流钾离子通道Kirbac [14]
- 大传导性机械式感应通道,(MscS)[15]
- 机械式感应通道|小传导性机械式感应通道(MscS)[16]
- 镁传输子|CorA金属离子传输子[17]
- 神经递质受体的配位体门离子通道(乙酰胆堿受体)[18]
- 水通道蛋白[19]
- 氯通道[20]
- 外膜辅助蛋白(多糖传输子)[21]来自细菌外膜的α-螺旋跨膜蛋白
带阿拉发-螺旋跨膜锚定的蛋白
- T细胞受体跨膜二聚化区域[22]
- 细胞色素c亚硝酸还原酶复合物[23]
- 磺基氢化酶[24]
- Stannin [25]
- 血型糖蛋白A二聚体[26]
- 丝状病毒(丝状噬菌体)主要包衣蛋白[27]
- 菌毛蛋白[28]
- 肺表面活性剂相关的蛋白[29]
- 单胺氧化酶A和B [30],
- 脂肪酸胺水解酶[11]
- 细胞色素CP450氧化酶[31]
- 盐皮质激素|皮质类固醇11β-脱氢酶[32]
- 信号肽肽酶[33]
- 专用于人类红细胞膜整合蛋白(stomatin)类似物的膜蛋白酶[34]
酶类
带阿拉发-螺旋跨膜锚定的蛋白
- T细胞受体跨膜二聚化区域[38]
- 细胞色素c亚硝酸还原酶复合物[39]
- 磺基氢化酶[40]
- Stannin [41]
- 血型糖蛋白A二聚体[42]
- 丝状病毒(丝状噬菌体)主要包衣蛋白[43]
- 菌毛蛋白[44]
- 肺表面活性剂相关的蛋白[45]
- 单胺氧化酶A和B [46],
- 脂肪酸胺水解酶[11]
- 细胞色素CP450氧化酶[47]
- 盐皮质激素|皮质类固醇11β-脱氢酶[48]
- 信号肽肽酶[49]
- 专用于人类红细胞膜整合蛋白(stomatin)类似物的膜蛋白酶[50]
由单肽链组成的β-筒状蛋白
- 来自于八个贝塔-折叠链并且剪切次数(shear number)为10的贝塔筒状蛋白(n=8, S=10)
[51]. 它们包括,:
-
- OmpA-样跨膜区域(OmpA),
- 病毒毒力相关的外膜蛋白家族(OmpX),
- 外膜蛋白W家族(OmpW),
- 抗菌肽耐药性和脂质A酰化作用蛋白家族(PagP)
- 脂质A脱酰化酶PagL,和
- 透明质家族孔蛋白(NspA)
- 自主转运蛋白结构域(n=12,S=14')[52]
- FadL外膜蛋白转运家族,包括脂肪酸转运蛋白FadL(n=14,S=14)[53]
- 普通细菌孔蛋白家族也叫三聚体(n=16,S=20)[54]
- 麦芽糖孔蛋白或糖孔蛋白(n=18,S=22)[55]
- 核苷特异孔蛋白(n=12,S=16)[56]
- 外膜磷脂酶A1(n=12,S=16)[57]
- TonB-依赖性受体和它们的TonB-依赖性受体#塞式结构域。它们是配体门控制外膜通道(n=22,S=24),包括钴胺转运蛋白BtuB、Fe (III) -绿脓杆菌螯铁蛋白受体FptA、三价铁羟肟酸摄取受体FhuA、转运子FecA、和荧光嗜铁素pyoverdine受体FpvA。[58]
- 外膜蛋白OpcA家族(n=10,S=12)包括外膜蛋白酶OmpT和黏附素/侵袭素OpcA蛋白[59]
- 外膜蛋白G孔蛋白家族(n=14,S=16)[60]
注释:n和S分别代表贝塔折叠链的数目和剪切次数[12] of the beta-barrel
由几个肽链组成的β-筒状蛋白
- 三聚体自主转运子(n=12,S=12)[61]
- 外膜外排蛋白,也叫三聚体外膜因子(n=12,S=18)包括TolC和多糖耐药蛋白[62]
- MspA孔蛋白(八聚物n=S=16)和α-溶血素(七聚物n=S=14) [63]这些蛋白是分泌的。也见短杆菌肽A[64]一种形成跨膜β-螺旋的二聚体的多肽。该多肽也由革兰氏阳性菌分泌。
参考文献
- ↑ Steven R. Goodman. Medical cell biology. Academic Press. 2008: pp. 37– [24 November 2010]. ISBN 9780123704580.
- ↑ Jin Xiong. Essential bioinformatics. Cambridge University Press. 2006: pp. 208– [13 November 2010]. ISBN 9780521840989.
- ↑ alpha-helical proteins in outer membranes include Stannin and certain lipoproteins, and others
- ↑ Almén MS, Nordström KJ, Fredriksson R, Schiöth HB. Mapping the human membrane proteome: a majority of the human membrane proteins can be classified according to function and evolutionary origin. BMC Biol.. 2009, 7: 50. doi:10.1186/1741-7007-7-50. PMID 19678920. PMC 2739160.
- ↑ Harvey Lodish etc.; Molecular Cell Biology, Sixth edition, p.546
- ↑ OPM database Rhodopsin-like proteins
- ↑ OPM database Photosynthetic reaction centers and photosystems
- ↑ OPM database Light-harvesting complexes
- ↑ OPM database Transmembrane cytochrome b like
- ↑ OPM database Cytochrome c oxidases
- ↑ 11.0 11.1 Bracey MH, Hanson MA, Masuda KR, Stevens RC, Cravatt BF. Structural adaptations in a membrane enzyme that terminates endocannabinoid signaling. Science. November 2002, 298 (5599): 1793–6. doi:10.1126/science.1076535. PMID 12459591.
- ↑ Murzin AG, Lesk AM, Chothia C. Principles determining the structure of beta-sheet barrels in proteins. I. A theoretical analysis. J. Mol. Biol.. March 1994, 236 (5): 1369–81. doi:10.1016/0022-2836(94)90064-7. PMID 8126726.
参见
- 细胞膜
- 跨膜受体s
- membrane topology
- transmembrane helix
- 膜蛋白
- integral membrane protein
- peripheral membrane protein
- intramembrane protease
|
|||||||||||
Transporter Classification database
参考来源
| 关于“跨膜蛋白”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |