罗斯曼折叠
| A+医学百科 >> 罗斯曼折叠 |
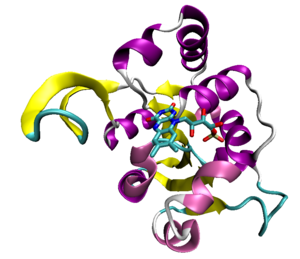
罗斯曼折叠(英语:Rossmann fold)是一种蛋白质结构基序,常见于核苷酸结合蛋白质,特别是辅因子NAD结合蛋白。该结构由两个重复的部分组成,每个部分包括6个平行的β折叠与两对α螺旋形成β-α-β-α-β的拓扑结构。因为每一个罗斯曼折叠可以和一个核苷酸结合,像NAD等二核苷酸的结合域包括二个成对的罗斯曼折叠,分别和辅因子的一个核苷酸部份结合。单一的罗斯曼折叠可以和单核苷酸结合,例如辅因子FMN。
该结构以迈克尔·罗斯曼命名,因其第一个发现这种多见于核苷酸结合蛋白(比如一些脱氢酶)的折叠结构[1]。
在1989年,魏茨曼科学研究学院的Israel Hanukoglu发现一些酶的NADP结合位点与和NAD结合的基序在序列一致性上有所不同[2],这一发现可以被用来重建辅酶特异性的酶[3]。
参考文献
- ↑ Rao S, Rossmann M. Comparison of super-secondary structures in proteins. J Mol Biol. 1973, 76 (2): 241–56. doi:10.1016/0022-2836(73)90388-4. PMID 4737475.
- ↑ Hanukoglu, I.; Gutfinger, T.. cDNA sequence of adrenodoxin reductase. Identification of NADP-binding sites in oxidoreductases.. Eur J Biochem. Mar 1989, 180 (2): 479–84. doi:10.1111/j.1432-1033.1989.tb14671.x. PMID 2924777.
- ↑ Scrutton NS, Berry A, Perham RN. Redesign of the coenzyme specificity of a dehydrogenase by protein engineering.. Nature. January 1990, 343 (6253): 38–43. doi:10.1038/343038a0. PMID 2296288.
|
|||||||||||||||||||||||
参考来源
出自A+医学百科 “罗斯曼折叠”条目 http://www.a-hospital.com/w/%E7%BD%97%E6%96%AF%E6%9B%BC%E6%8A%98%E5%8F%A0 转载请保留此链接
| 关于“罗斯曼折叠”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |