糖原磷酸化酶(英语:Glycogen phosphorylase;EC 2.4.1.1)是糖原分解代谢中的关键酶,催化糖原的磷酸解反应。
概述
糖原磷酸化酶催化的糖原分解反应底物为糖原和无机磷酸,产物为葡糖-1-磷酸和少一葡糖单位的糖原,反应总是从糖原的非还原端开始。虽然这一反应的标准自由能变化为正值,但由于细胞内无机磷酸的浓度远远超过葡糖-1-磷酸的浓度,因此此分解反应可以顺利进行。
糖原磷酸化酶只能打断某些α(1→4)糖苷键,并不能作用糖原分子分支部分的α(1→6)糖苷键。而且,对于与分支点相距三个葡糖残基的α(1→4)糖苷键,糖原磷酸化酶同样是无能为力,这些糖苷键只有借助脱支酶才能水解。
糖原磷酸化酶在哺乳动物中主要存在三种同工酶:肌型、肝型和脑型。
结构
糖原磷酸化酶由两个完全相同的97k亚基组成,每一个亚基与一分子磷酸吡哆醛辅基通过亚胺的形式共价结合,具N端(1~484aa)和C端(484~842aa)两个结构域。磷酸吡哆醛的作用不明,有研究显示用硼氢化钠将其亚胺结构还原对酶的活性亦没有影响,所以一般认为只有其上相连的磷酸基团行使催化作用,而与吡哆醛无关。
糖原磷酸化酶的催化过程起始于处于磷酸吡哆醛与糖原之间的无机磷酸,它贡献一个质子给将要断裂的非还原端葡糖残基,使之形成半椅型的氧正离子中间体,然后该中间体被磷酸根离子进攻,从而产生葡糖-1-磷酸。整个过程中酶的磷酸吡哆醛辅基行广义酸碱催化,负责向反应进程中的磷酸根离子提供或夺取质子。 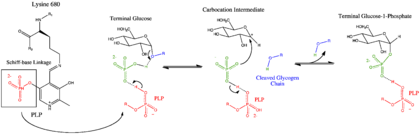
调节
糖原磷酸化酶的活性受到别构效应物和共价修饰的调节,不过对于糖原磷酸化酶的各种同功酶,受功能和结构上差异的影响,其调节机制事实上不尽相同。
外部链接
参考来源
更多医学百科条目
