拉乌尔定律
| A+医学百科 >> 拉乌尔定律 |
拉乌尔定律(Raoult's law):物理化学的基本定律之一,是
法国物理学家F.-M.拉乌尔在1887年研究含有非挥发性溶质的稀溶液的行为时发现的,可表述为:“在某一温度下,稀溶液的蒸气压等于纯溶剂的蒸气压乘以溶剂的摩尔分数”。
其数学表达式为:
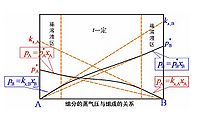
pA=p xA式中pA是溶液中溶剂的蒸气分压;p是纯溶剂的蒸气压;xA是溶剂的物质的
量分数。
该定律是法国物理学家F.M.拉乌尔于1887年在实验基础上提出的,它是稀薄溶液的基本规律之一。对于不同的溶液,虽然定律适用的浓度范围不同,但在xA→1的条件下任何溶液都能严格遵从上式。拉乌尔定律最初是在研究不挥发性非电解质的稀薄溶液时总结出来的,后来发现,对于其他稀薄溶液中的溶剂也是正确的。在任意满足xA→1的溶液中,溶剂分子所受的作用力几乎与纯溶剂中的分子相同。所以,在一个溶液中,若其中某组分的分子所受的作用与纯态时相等,则该组分的蒸气压就服从拉乌尔定律。
拉乌尔定律是溶液热力学研究的基础,它对相平衡和溶液热力学函数的研究起指导作用。
在非电解质的稀溶液中,溶剂的蒸气压P,等于纯溶剂的蒸气压P0与该溶液中所含溶剂
的克分子分数N0(溶剂克分子数与溶剂及溶质总克分子数的比数)的乘积:P=P0×N0。
是法国人拉乌尔在1880年所提出的。应用于蒸馏和吸收等过程的计算中。
出自A+医学百科 “拉乌尔定律”条目 http://www.a-hospital.com/w/%E6%8B%89%E4%B9%8C%E5%B0%94%E5%AE%9A%E5%BE%8B 转载请保留此链接
| 关于“拉乌尔定律”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |