医用化学/缓冲溶液PH的计算
| 医学电子书 >> 《医用化学》 >> PH值与缓冲溶液 >> 缓冲溶液 >> 缓冲溶液PH的计算 |
| 医用化学 |
|
|
|
(一)亨德森方程式
在缓冲溶液例如HOAc-NaOAc溶液中,有以下的离解平衡:
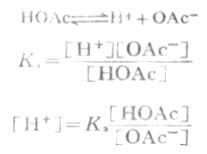
等式两边各取负对数,则
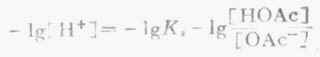
即 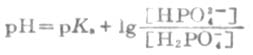
HOAc的离解度比较小,由于溶液中大量的OAc-对HOAc所产生的同离子效应,使HOAc的离解度变得更小。因此上式中的[HOAc]可以看作等于HOAc的总浓度[共轭酸](即缓冲溶液中共轭酸的浓度)。同时,在溶液中NaOAc全部离解,可以认为溶液中[OAc-]等于NaOAc的总浓度[共轭碱](即配制的缓冲溶液中共轭碱的浓度)。将[共轭酸]和[共轭碱]代入上式,则得
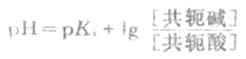 (3-11)
(3-11)
上式称为亨德森-哈塞尔巴赫方程式,简称为亨德森(Henderson)方程式。它表明缓冲溶液的
PH值决定于共轭酸的离解常数Ka和组成缓冲溶液的共轭碱与共轭酸浓度的比值。对于一定的共轭酸,PKa为定值,所以缓冲溶液的PH就决定于两者浓度的比值即缓冲比。当缓冲溶液加水稀释时,由于共轭碱和共轭酸的浓度受到同等程度的稀释,缓冲比是不变的;在一定的稀释度范围内,缓冲溶液的PH值实际上也几乎不变。
式(3-11)中的浓度项指的是混合溶液中共轭酸碱的浓度,而不是混合前的浓度.若混合前共轭酸的量浓度是c酸,体积是V酸,共轭碱的量浓度是c碱,体积是V碱,则式(3-11)可改写成:
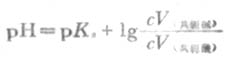 (3-12)
(3-12)
若两种溶液的量浓度相等,则
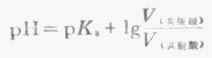 (3-13)
(3-13)
若是等体积的两溶液相混合,则
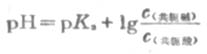 (3-14)
(3-14)
以上几种形式都称为亨德森方程式,可用以计算各种组成类型缓冲溶液的PH近似值。当用于弱酸及其对应的盐组成的缓冲溶液的PH值时,PKa即弱酸的离解常数负对数(见书后附表),[共轭碱]即[弱酸盐]。当用于多元弱酸的酸式盐及其对应的次级盐组成缓冲溶液的PH值时,共轭酸即酸式盐,pKa即该酸式盐负离子的离解常数的负对数,共轭碱即该酸式盐的次级盐。例如,NaHCO3-Na2CO3缓冲溶液的PH值:
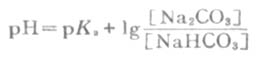 (3-15)
(3-15)
式中PKa即H2CO3的PKa2。
同样,NaH2PO4-Na2HPO4缓冲溶液的PH值:
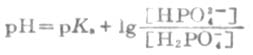 (3-16)
(3-16)
式中PKa为H3PO4的PKa2。
弱碱和它的共轭酸缓冲溶液的PH值也可根据式(3-11)计算。
(二)缓冲溶液PH值计算举例
例5 0.1mol.L-1的HOAc500mL与0.2mol.L-1的NaOAc250mL配成缓冲溶液,计算溶液的pH值。
解:把所给条件代入式(3-11),由书后附表查得HOAc的pKa=4.75,则得:
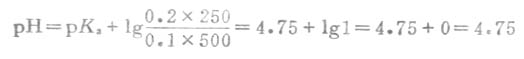
例6 将0.3mol.L-1HOAc溶液10mL与0.1mol.L-1NaOH溶液10mL混合后制成缓冲溶液,试计算这个溶液的pH值(2.5℃时,HOAc时pKa=4.75)。
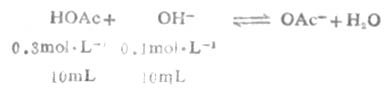
从反应看出HOAc有1/3被OH-中和,生成OAc-和H2O,溶液的总体积为20mL。
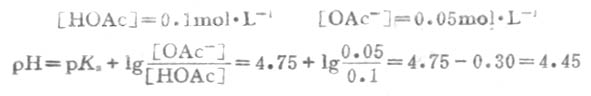
例7 H2PO2-4已知的pKa=7.21,求浓度为0.100mol.L-1、pH7.40的磷酸盐缓冲溶液的缓冲比以及共轭碱HPO2-4和共轭酸H2PO2-4的浓度。
解:设[H2PO2-4]为χmol.L-1,因缓冲溶液的总浓度(共轭酸浓度+共轭碱浓度)为已c=0.100mol.L-1,故[H2PO2-4]=(0.100-χ)mol.L-1
根据式(3-11)或式(3-14):
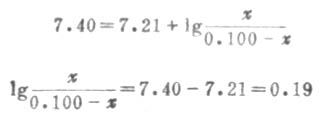
缓冲比为 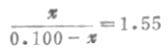
χ=0.061,[HPO2-4]=0.061mol.L-1
0.100- χ=0.100-0.061=0.039,[ H2PO2-4]=0.039mol.L-1
| 关于“医用化学/缓冲溶液PH的计算”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |