医用化学/沉淀的生成和溶解
| 医学电子书 >> 《医用化学》 >> 电解质溶液 >> 沉淀-溶解平衡 >> 沉淀的生成和溶解 |
| 医用化学 |
|
|
|
在某微溶电解质溶液中,各有关离子浓度幂之乘积称为离子积。对于MmAa微溶电解质来说,溶液中[M]m[A]n称为它的离子积它可以是任意数值,不是常数,因为并未注明是饱和溶液。离子积和溶度积两者的概念是有区别的。①当溶液中[M]m[A]n<Ksp时,是未饱和溶液,如果体系中有固体存在,将继续溶解,直至饱和为止;②当[M]m[A]n = Ksp时,是饱和溶液,达到动态平衡;③当[M]m[A] n>Ksp时,将会有MmAn沉淀析出,直至成为饱和溶液。以上三点称为溶度积规则,它是微溶电解质多相离子平衡移动规律的总结。根据溶度积规则可以控制离子浓度,使沉淀生成或溶解。
(一)沉淀的生成
根据溶度积的规则,在微溶电解质溶液中,如果离子积大于溶度积常数Ksp,就会有沉淀生成。因此,要使溶液析出沉淀或要使沉淀得更完全,就必须创造条件,使其离子积大于溶度积。
例9 AgCL的Ksp=1.80×10-10,将0.001 mol.L-1NaCL和0.001 mol.L-1AgNO3溶液等体积混合,是否有AgCl 沉淀生成.
解: 两溶液等体积混合后, Ag+ 和CL-浓度都减小到原浓度的1/2.
[Ag+]=[CL-]=1/2×0.001=0.005(mol.L-1)
在混合溶液中,则[Ag+][CL-]=(0.005)2=2.5×10-7
因为[Ag+][CL-]>Ksp,所以有AgCl 沉淀生成.
例10 在0.1mol.L-1KCL和0.1 mol.L-1K2CrO4混合溶液中,逐滴加入AgNO3溶液,问AgCL和AgCrO4两种微溶电解质,哪个最先产生沉淀?
解:设混合液中产生AgCL沉淀时,所需[Ag+]为x mol.L-1,而产生Ag2CrO4沉淀时,所需[Ag+]为y mol.L-1;已知AgCL的Ksp=1.80×10-10,Ag2CrO4的Ksp=1.1×10-12.
根据溶度积常数表达式,则
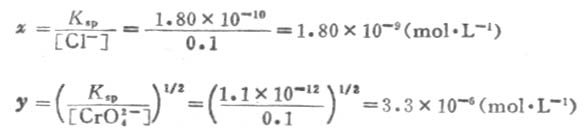
因为x《y ,就是说产生AgCL沉淀时所需Ag+的浓度远小于产生AgCrO4沉淀时所需Ag+的浓度。所以,在混合溶液中,逐滴加入AgNO3溶液时,最先析出AgCL白色沉淀;只有溶液中[Ag+]达到3.3×10-6mol.L-1以上时,才能析出Ag2CrO4砖红色沉淀。
由此可见,溶液中有两种以上都能与同种离子反应产生沉淀的离子时,最先析出的是溶解度较小的化合物,这就是分步沉淀。
例11 BaSO4在水中的溶解度是1.05×10-5 mol.L-1,问在0.01 mol.L-1Na2SO4溶液中BaSO4的溶解度是多少?
解: BaSO4的Ksp=1.1×10-10,BaSO4在溶液中的离解平衡:
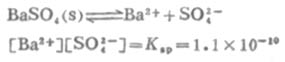
设在0.01 mol.L-1Na2SO4溶液中BaSO4的溶解度为x mol.L-1,则[Ba2+]=x mol.L-1,[SO2-4]=(0.01+x) mol.L-1因为x值远小于0.01,可以忽略不计,则(0.01+x)≈0.01,所以
x×0.01=1.1×10-10
x=1.1×10-8
由此可见,在微溶电解质饱和溶液中,加入含有相同离子的强电解质时,将使微溶电解质的溶解度降低,这就是前面所讲到的同离子效应.所以,加入适当过量的沉淀剂,可以使沉淀更趋完全,达到我们所要求的目的.
(二)沉淀的溶解
根据溶度积原理,沉淀溶解的必要条件是溶液中离子积小于溶度积Ksp因此,创造一定条件,降低溶液中的离子浓度,使离子积小于其溶度积,就可使沉淀溶解.
使沉淀溶解的常用方法主要有三种:
大多数微溶氢氧化物都能溶于强酸.例如Fe(OH)3能溶于盐酸.反应如下:
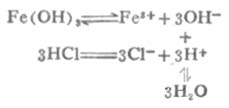
由于溶液中生成了弱电解质H2O,使[OH]-减小,溶液中[Fe3+][OH-]3<Fe(OH)3的Ksp,使平衡向Fe(OH)3溶解的方向移动,即向右移动.若有足量盐酸,沉淀可以完全溶解.
少数微溶氢氧化物能溶于铵盐.例如Mg(OH)2溶于铵盐的反应如下:
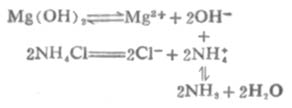
由于溶液中生成了弱电解质NH3和H2O,使[OH-]减小,溶液中[Mg2+][OH-]2<Mg(OH)2的Ksp,使平衡向Mg(OH)2溶解的方向移动。若有足量铵盐,沉淀可以完全溶解。
大多数微溶弱酸盐都能溶于强酸,例如CaCO3能溶于盐酸。反应如下:
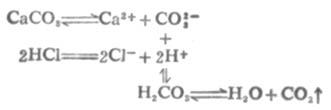
由于溶液中生成了弱电解质H2CO3,H2CO3不稳定,分解成H2O和CO2,CO2从溶液中逸出,使[CO2-3]减小。所以溶液中[Ca2+][CO2-3]<CaCO3的Ksp,平衡向CaCO3溶解的方向移动。若有足量盐酸,沉淀可以完全溶解。
2.加入适当氧化剂或还原剂,与溶液中某种离子发生氧化-还原反应。 例如,在CuS沉淀中加入稀HNO3,因为S2-被氧化成单质硫,从而使溶液中[S2-]减小,所以溶液中[Cu2+][S2-]<CuS的Ksp,使CuS沉淀逐步溶解。反应如下:
3CuS+8HNO3=3Cu(NOa)2+2NO↑+4H2O+3S↓
3.加入适当试剂,与溶液中某种离子结合生成配合物。
例如,AgCL沉淀能溶于氨水。反应如下:
由于生成了稳定的[Ag(NH3)2]+,大大降低了Ag+的浓度,所以AgCL沉淀溶解。
应当指出,在含有沉淀的溶液中,加入适当试剂与溶液中某种离子结合生成更难溶解于水的物质,这叫做沉淀转化。例如,在PbCL2沉淀中,加入Na2CO3溶液后,又生成了一种新的沉淀PbCO3。反应如下:
![]()
由于反应生成了更难溶解的PbCO3沉淀,降低了溶液中[Pb2+],使平衡向生成PbCO3沉淀的方向移动,所以PbCL2沉淀溶解。
由此可见,在有微溶电解质固体存在的溶液中,只要有关离子积小于Ksp,这种微溶电解质就能溶解。因此,在实际工作中,常在有微溶电解质固体存在的溶液中加入某种物质,如能与微溶电解质的离子反应,生成弱电解质、配合物、更难溶解垢物质或可以发生氧化还原反应,从而破坏了沉淀与离子间的平衡,可以促进微溶电解质的溶解或转化。
| 关于“医用化学/沉淀的生成和溶解”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |