乙酸乙酯
| A+医学百科 >> 乙酸乙酯 |
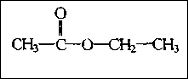
乙酸乙酯是乙酸中的羟基被乙氧基取代而生成的化合物,结构简式为CH3COOCH2CH3。
乙酸乙酯 ethyl acetate
乙酸乙酯又称醋酸乙酯。纯净的乙酸乙酯是无色透明有芳香气味的液体,是一种用途广泛的精细化工产品,具有优异的溶解性、快干性,用途广泛,是一种非常重要的有机化工原料和极好的工业溶剂,被广泛用于醋酸纤维、乙基纤维、氯化橡胶、乙烯树脂、乙酸纤维树酯、合成橡胶、涂料及油漆等的生产过程中。其主要用途有:作为工业溶剂,用于涂料、粘合剂、乙基纤维素、人造革、油毡着色剂、人造纤维等产品中;作为粘合剂,用于印刷油墨、人造珍珠的生产;作为提取剂,用于医药、有机酸等产品的生产;作为香料原料,用于菠萝、香蕉、草莓等水果香精和威士忌、奶油等香料的主要原料。我们所说的陈酒很好喝,就是因为酒中含有乙酸乙酯。乙酸乙酯具有果香味。因为酒中含有少量乙酸,和乙醇进行反应生成乙酸乙酯。因为这是个可逆反应,所以要具有长时间,才会积累导致陈酒香气的乙酸乙酯。
名称
名称1: 乙酸乙酯 ethyl acetate
名称2: 醋酸乙酯 acetic ester
CAS No.: 141-78-6
分子式 C4H8O2
结构式CH3COOC2H5
相对分子质量 88.11
存在:除人工合成外,还存在于许多酒以及菠萝、香蕉等果品中。
目录 |
外观与性状
外观:无色澄清液体。
香气:有强烈的醚似的气味,清灵、微带果香的酒香,易扩散,不持久。
熔点(℃): -83.6
折光率(20℃):1.3708--1.3730
沸点(℃): 77.06
相对密度(水=1): 0.894--0.898
相对蒸气密度(空气=1): 3.04
饱和蒸气压(kPa): 13.33(27℃)
燃烧热(kJ/mol): 2244.2
临界温度(℃): 250.1
临界压力(MPa): 3.83
辛醇/水分配系数的对数值: 0.73
闪点(℃)(开杯): 7.2
引燃温度(℃): 426
爆炸上限%(V/V): 11.5
爆炸下限%(V/V): 2.0
室温下的分子偶极距:6.555*10^-30
溶解性: 微溶于水,溶于醇、酮、醚、氯仿等多数有机溶剂。
主要用途
用途很广。主要用作溶剂,及用于染料和一些医药中间体的合成。是食用香精中用量较大的合成香料之一,大量用于调配香蕉、梨、桃、菠萝、葡萄等香型食用香精.
注意事项
1.健康危害: 对眼、鼻、咽喉有刺激作用。高浓度吸入可进行麻醉作用,急性肺水肿,肝、肾损害。持续大量吸入,可致呼吸麻痹。误服者可产生恶心、呕吐、腹痛、腹泻等。有致敏作用,因血管神经障碍而致牙龈出血;可致湿疹样皮炎。慢性影响:长期接触本品有时可致角膜混浊、继发性贫血、白细胞增多等。
2.燃爆危险: 本品易燃,具刺激性,具致敏性。
3.危险特性: 易燃,其蒸气与空气可形成爆炸性混合物,遇明火、高热能引起燃烧爆炸。与氧化剂接触猛烈反应。其蒸气比空气重,能在较低处扩散到相当远的地方,遇火源会着火回燃。
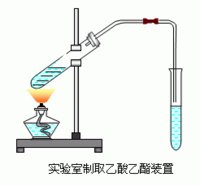
实验室制取乙酸乙酯
乙酸乙酯的制取:先加乙醇,再加浓硫酸(加入碎瓷片以防暴沸),最后加乙酸, 然后加热(可以控制实验)
乙酸的酯化反应制乙酸乙酯的方程式:
CH3COOH+CH3CH2OH===CH3COOC2H5+H2O
(可逆反应、加热、浓硫酸催化剂、吸水剂、脱水剂)
1:酯化反应是一个可逆反应。为了提高酯的产量,必须尽量使反应向有利于生成酯的方向进行。一般是使反应物酸和醇中的一种过量。在工业生产中,究竟使哪种过量为好,一般视原料是否易得、价格是否便宜以及是否容易回收等具体情况而定。在实验室里一般采用乙醇过量的办法。乙醇的质量分数要高,如能用无水乙醇代替质量分数为95%的乙醇效果会更好。催化作用使用的浓硫酸量很少,一般只要使硫酸的质量达到乙醇质量的3%就可完成催化作用,但为了能除去反应中生成的水,应使浓硫酸的用量再稍多一些。
2:制备乙酸乙酯时反应温度不宜过高,要保持在60 ℃~70 ℃左右,温度过高时会产生乙醚和亚硫酸等杂质。液体加热至沸腾后,应改用小火加热。事先可在试管中加入几片碎瓷片,以防止液体暴沸。
3导气管不要伸到Na2CO3溶液中去,防止由于加热不均匀,造成Na2CO3溶液倒吸入加热反应物的试管中。
3.1:浓硫酸既作催化剂,又做吸水剂和脱水剂。
3.2:Na2CO3溶液的作用是:
(1)饱和碳酸钠溶液的作用是冷凝酯蒸气,减小酯在水中的溶解度(利于分层),除出混合在乙酸乙酯中的乙酸,溶解混合在乙酸乙酯中的乙醇。
(2)Na2CO3能跟挥发出的乙酸反应,生成没有气味的乙酸钠,便于闻到乙酸乙酯的香味。
3.3:为有利于乙酸乙酯的生成,可采取以下措施:
(1)制备乙酸乙酯时,反应温度不宜过高,保持在60 ℃~70 ℃。不能使液体沸腾。
(2)最好使用冰醋酸和无水乙醇。同时采用乙醇过量的办法。
(3)起催化作用的浓硫酸的用量很小,但为了除去反应中生成的水,浓硫酸的用量要稍多于乙醇的用量。
(4)使用无机盐Na2CO3溶液吸收挥发出的乙酸。
3.4:用Na2CO3不能用碱(NaOH)的原因。
虽然也能吸收乙酸和乙醇,但是碱会催化乙酸乙酯彻底水解,导致实验失败。
参见
烷基乙酸酯
.乙酸甲酯(methyl acetate)
.乙酸丙酯(n-Propyl acetate )
.乙酸异丙酯(isopropyl acetate)
.乙酸丁酯(butyl acetate)
.乙酸异丁酯(isobutyl acetate)
.乙酸戊酯(amyl acetate)
.乙酸异戊酯(isoamyl acetate)
.乙酸己酯(hexyl acetate)
.乙酸庚酯(n-heptyl acetate)
.乙酸辛酯(octyl acetate)
.乙酸壬酯(nonyl acetate)
.乙酸癸酯(decyl acetate)
| 关于“乙酸乙酯”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |