临床生物化学/比色法与分光亮度法
| 医学电子书 >> 《临床生物化学》 >> 血清酶定量的检测技术 >> 酶活性测定的常用技术和方法 >> 比色法与分光亮度法 |
| 临床生物化学 |
|
|
在20世纪上半个世纪华勃仪得到研究实验室广泛的应用,并在酶学上得到丰硕的成果。但此法操作烦琐,技术要求高而且灵敏度低。临床常规中很少使用。多使用简单易行的比色法测酶活性。在上半个世纪建立了一些适用于常规工作的测酶活性浓度的方法,如测定淀粉酶的Somogyi法,碱性磷酸酶的Bodansky法、King法等等。这些方法都是在酶和底物作用一段时间后停止酶反应,加入各种化学试剂与产物或基质反应呈色,用比色计在可见光处比色,同时将被测物质作标准管或标准曲线,比较后计算出在此段时间内产物生成量或底物消耗量,从而求得反应速率v。
比色法从50年代起逐步被分光光度法所取代。这是因为分光光度法有以下几个显著优点:一是测定范围不只局限在可见光,还可扩展到紫外和红外部分。这就为扩大测定酶范围提供了可能性。二是提供了寻找一类不需停止酶反应就可直接测定产物生成量或底物消耗量方法的可能性。例某一酶催化下列反应A->B+C,A、B、C三种物质用分光光度法的吸收光谱如图17-1所示。
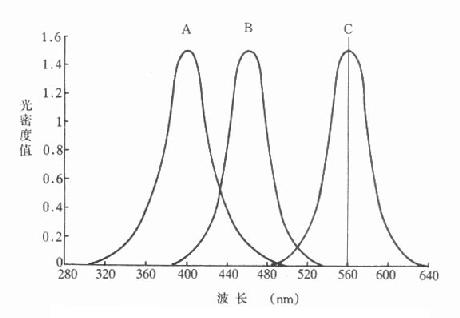
图17-1 A、B、C三种物质的吸收曲线
可以看到C在560nm处有一吸收峰,而A和B在此处无吸光度变化因此无需停止酶反应,只要在560nm处测定吸光度变化就很容易计算出C的变化速度,而且C物质比A、B二物质有更高的吸收峰,即灵敏度最高。
这类方法中最成功的是Warburg在50年代利用NAD(P)H和NAD(P)吸收光谱差异建立的测酶活性浓度方法。NAD(P)H在340nm处有一吸收峰,而NAD(P)在此波段却毫无吸光性。因此建立了一类和原来比色法截然不同方法。不需停止酶反应,在340nm根据吸光度变化,就可观察到酶反应变化全过程。
第三个优点是不需要如比色法那样,作标准管或标准曲线,因为分光光度计使用近似单色光的光源,在此条件下,某一特定物质的吸光度为常数,即人们所熟悉的摩尔吸光度(molar absorbance)。根据此值从吸光度△A/△T不难计算出酶催化反应速度v。
分光光度计的这些简便、准确等特点使它在近年来已逐步取代比色法而成为目前最流行的方法。其缺点是需要精确带恒温装置的分光光度计,在经济不发达地区尚难推广。
分光光度法的技术多样化。设计得当可用于各种酶的测定。表17-2是一些可用于分光光度法的氧化还原物质特性。
除了前述的NAD(P)H系统可用于脱氢酶测定外,可利用黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD)来测定各种含这二个辅基的酶。它们的氧化型在450nm有一很强吸收峰,而还原型的吸光度很低,同样细胞色素还原型在可见光有一个非常明显和很窄的吸收峰,都使人们很容易用分光光度法研究这些酶的作用。上述物质主要用于氧化还原酶的测定。
科学家还设计出一系列人工合成酶的底物,用于其它酶的分光光度法测定。例如合成了很多对硝基酚的衍生物,用于各种水解酶的测定。碱性磷酸酶底物磷酸对硝基酚就是一个成功例子。又如测芳香基硫酸酯酶,可使用人工合成的硫酸对硝基酚为底物,其分解产物的吸收峰由原来的278nm变为318nm,Webb成功地在330nm进行此酶监测。
表17-2 一些氧化还原物质的特性
| 物质 | 波长(nm) | 克分子吸光度 | |
| 还原型 | 氧化型 | ||
| NAD,NADP | 340 | 6300 | 0 |
| FMN | 450 | 12200 | |
| FAD | 450 | 11300 | |
| 细胞色素C | 550 | 29500 | 8300 |
| 亚甲蓝(等消光点) | 610 | 0 | 41000 |
| 二氢酚吲哚酚 | 600 | 0 | 21000 |
| 吩嗪甲酯硫酸 | 388 | 1500 | 22000 |
| 抗坏血酸 | 265 | 15100 | |
| 连二亚硫酸盐 | 314 | 8000 | 0 |
| 氰化铁(亚铁) | 420 | 0 | 1020 |
分光光度法的上述原理还可以用于其它酶的测定,如烯醇化酶、延胡索酸水解酶的底物由于含不饱和键,在330nm处有很强吸收峰,而酶作用产物无此不饱和键。则不难在330nm处对这些酶进行直接测定。
此后在分光光度法的发展过程中又导入了酶偶联技术。使得分光光度法几乎能测定所有的酶。因此临床实验室工作者如不能很好掌握分光光度法的技术,不了解各种影响因素,要作好酶的测定是很困难的。
| 关于“临床生物化学/比色法与分光亮度法”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |