过氧化镁
| A+医学百科 >> 过氧化镁 |
| 过氧化镁 | |
|---|---|
 |
|
| IUPAC名 Magnesium peroxide |
|
| 识别 | |
| CAS号 | 1335-26-8 |
| PubChem | 61745 |
| ChemSpider | 55637 |
| SMILES |
|
| InChI |
|
| InChIKey | SPAGIJMPHSUYSE-UHFFFAOYAN |
| EINECS | 238-438-1 |
| ATC代码 | A02AA03,A06 |
| 性质 | |
| 化学式 | MgO2 |
| 摩尔质量 | 56.3038 g/mol g·mol⁻¹ |
| 外观 | 白色至灰白色粉末 |
| 密度 | 3 g/cm3 |
| 熔点 | 223 °C |
| 沸点 | 350 °C (decomp) |
| 溶解性(水) | 不溶 |
| 结构 | |
| 晶体结构 | 立方晶系, cP12 |
| 空间群 | Pa3, No. 205 |
| 危险性 | |
| 警示术语 | R:R8 |
| 安全术语 | S:S17, S36 |
| 主要危害 | Oxidizing (O) |
| NFPA 704 | |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
过氧化镁(化学式:MgO2)是镁的过氧化物,室温下为白色至灰白色粉末。无水MgO2只能在液氨溶液中获得,而在水中的反应将导致生成各种水合物。[1]商品过氧化镁通常是MgO2和Mg(OH)2的混合物,作为医疗用途时,常使用名称"Oxy-C"。
目录 |
结构
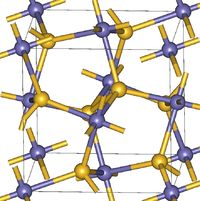
MgO2晶体具有黄铁矿结构,这与同族过氧化物CaO2,SrO2,BaO2类似CaC2的结构不同。[1]此结构中,Mg处于O2基团的侧面,Mg与O2之间的键能为90kJ/mol。[2]
制备
MgO2可由氧化镁和过氧化氢混合制得,这是一个放热反应,需要及时冷却,控制反应温度在30-40摄氏度,同时,应当避免引入能催化过氧化氢分解的金属离子杂质。加入硅酸钠这类稳定剂也能抑制过氧化氢分解。即便如此,这类反应的最高产率也只有35%。[3]
应用
MgO2能稳定地释放氧,适用于农业或环境相关的行业,如减少地下水污染物的含量,不过由于这本身也引入了化学物质,只用于恢复已经遭受污染的地下水。[4]MgO2还用于恢复被污染的土壤并改善植物的生长和代谢。MgO2添加到堆肥中能促进微生物的活动,同时减弱堆肥因此产生的气味。[5]在某些情况下,MgO2也可抑制如硫酸盐还原细菌的生长,这可能因为缓慢分解的过氧根离子代替了硫酸根离子在反应的电子传递链中得电子。[6]
毒性
与其它过氧化物一样,MgO2具有刺激性,可引起红肿,瘙痒,肿胀,接触可灼伤皮肤和眼睛;不慎吸入导致鼻子,咽喉与肺部的刺激而引起咳嗽。长期接触会导致肺损伤,气短,胸部收紧。长期的MgO2摄入可产生多种不良症状,包括包括口腔和咽喉的刺激,嗳气,恶心,呕吐,上腹部疼痛,腹胀和腹泻。[7][8] MgO2不是天然存在的化合物,也不会长时间残留于环境中,它会自然分解成Mg(OH)2与O2。但是作为氧化剂,MgO2应当与纸,布,木材这类易燃物隔离。
参考资料
- ↑ 1.0 1.1 《元素化学》 N.N.格林伍德,A.厄恩肖著,曹庭礼 王致勇 张弱非 单辉 白桂蓉 等译,高等教育出版社
- ↑ Plowright, Richard J.; Thomas J. McDonnell, Timothy G. Wright, and John M. C. Plane. Theoretical Study of Mg+?X and [X?Mg?Y]+Complexes Important in the Chemistry of Ionospheric Magnesium (X, Y = H2O, CO2, N2, O2, and O). Journal of Physical Chemistry. 28, 113 (33): 9354–9364. doi:10.1021/jp905642h. PMID 19637880.
- ↑ Shand, Mark A.. THE CHEMISTRY AND TECHNOLOGY OF MAGNESIA. Hoboken, NJ: John Wiley & Sons. 2006. ISBN 978-0-471-65603-6.
- ↑ Rockne, Karl J.; Krishna R. Reddy. BIOREMEDIATION OF CONTAMINATED SITES. International e-Conference on Modern Trends in Foundation Engineering: Geotechnical Challenges and Solutions. October 2003 [2012-04-18].
- ↑ Vidali, M.. Bioremediation. An overview. Pure Appl. Chem.. 2001, 73 (7): 1163–1172 [2012-04-18].
- ↑ Chang, Yu-Jie; Yi-Tang Chang and Chun-Hsiung Hung. The use of magnesium peroxide for the inhibition of sulfate-reducing bacteria under anoxic conditions. J Ind Microbiol Biotechnol. 2008: 1481–1491.
- ↑ Product Safety Summary: Magnesium Peroxide. Solvay America Inc. [25 April 2012].
- ↑ Pohanish, Richard P.. Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens. William Andrew. 2011: pp. 1645–1646. ISBN 1437778704.
参考来源
| 关于“过氧化镁”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |
