生物化学与分子生物学/弹性蛋白及角蛋白
| 医学电子书 >> 《生物化学与分子生物学》 >> 结缔组织生化 >> 弹性蛋白及角蛋白 |
| 生物化学与分子生物学 |
|
|
一、弹性蛋白
弹性蛋白构成弹性纤维,弹性纤维是有橡皮样弹性的纤维,能被拉长数倍,并可恢复原样,它是结缔组织弹性的主要因素。弹性蛋白分布没有胶原蛋白广泛,但在组织内也大量存在,如富有弹性的组织,肺、大动脉、某些韧带、皮肤及耳部软骨等。
弹性蛋白中疏水性氨基酸含量高达95%,其中有许多是甘氨酸、脯氨酸和亮氨酸。弹性蛋白初合成时为水溶性单体,分子量为70000,称为原弹性蛋白(tropoelastin),在修饰中部分脯氨酸羟化生成羟脯氨酸。原弹性蛋白从细胞中分泌出来后,部分赖氨酸经氧化酶催化氧化为醛基,并与另外的赖氨酸的ε-氨基缩合成吡啶衍生物,称为链素(图13-10)。
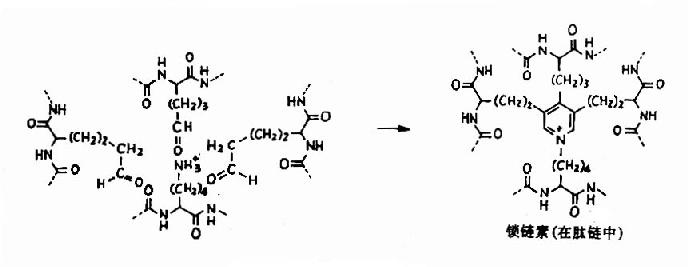
图13-10
交联后使弹性蛋白卷曲,从而具有弹性、并且使弹性蛋白溶解性降低,稳定性增高。
二、角蛋白
角蛋白(kevatin)是皮肤、毛发和指甲等组织的重要组成成分。是一种抗机械、抗化学刺激的蛋白质,存在于所有高等脊椎动物体中。角蛋白可分为α角蛋白(αkevatin),主要存在于哺乳动物;和β角蛋白(βkevatin),主要分布于鸟类和爬行动物。哺乳动物有30种不同的角蛋白,可分为相对酸性(Ⅰ型)和碱性(Ⅱ型)两类多肽。

图13-11头发的显微结构
通过电子显微镜分析表明:毛发主要由α角蛋白组成,一根典型毛发直接约20μm,由死细胞组成。由约80粗的微纤维(microfibril)通过二硫键交联构成的巨纤维(macrofibrils)组成。
角蛋白中的肽链卷曲为α螺旋,两条分别为Ⅰ型和Ⅱ型的角蛋白肽链紧密结合为平行的左手螺旋二聚体(dimer)此二聚体首-尾相连构成原纤维(protofibril),4条原纤维构成微纤维(microfibril)(图13-11),微纤维再横向粘合为200μm直径的巨纤维(macrofibril)。α-角蛋白富含半胱氨酸,并能与邻近的多肽链通过二硫键进行交联,因此,α-角蛋白很难溶解,并受得起一定的拉力。烫发时先用巯基化合物破坏二硫键使之易于卷曲,然后用氧化剂恢复二硫键使卷曲固定。
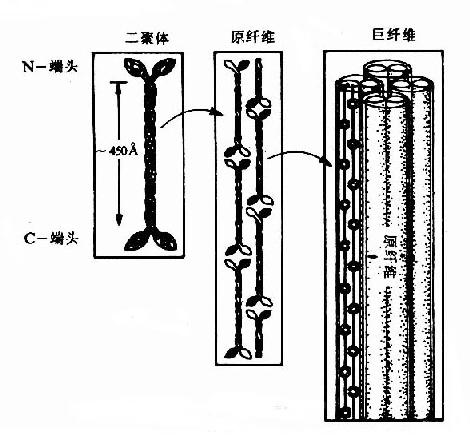
图13-12 α角蛋白的结构
遗传性皮肤疾病表皮松懈单片疱疹(epidermolysis bullosa zimplex EBS)和表皮松懈角化过度症(epidermolytichyperkeratosis,EHK)在对常人无害的机械摩擦下使上皮基底细胞和表皮基底细胞破裂而生成水疱为特征。研究表明EBS主要是皮肤14或5型角蛋白的异常,而EHK则主要是1或10型角蛋白的异常,由此可见角蛋白在维持人体正常生理防护功能方面有重要意义。
| 关于“生物化学与分子生物学/弹性蛋白及角蛋白”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |