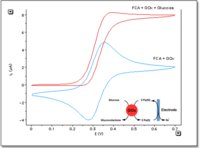
滴定曲线
| A+医学百科 >> 滴定曲线 |
滴定曲线(titration curves),一种表示滴定(见容量分析)过程中溶液性质变化的图示。滴定曲线大致可分为两类:①用浓度的对数函数表示。曲线呈S形,由曲线等当点附近的变化,可以判定能否用指示剂确定终点,并据此选择合适的指示剂;②用正比于浓度的某种性质表示,滴定曲线是两条直线,只是在等当点附近有些弯曲,由两直线(或其延长线)的交点确定终点。仪器分析方法确定终点大多是这种情况。
用氢氧化钠滴定盐酸时,在等当点附近,曲线几乎是垂直线,表示加入少量氢氧化纳时pH会发生很大的变化,称为滴定突跃。在等当点前0.1%到等当点后0.1%之间,溶液的pH由4.3变为9.7,相当于加入一滴氢氧化钠溶液能使 H+的浓度改变几十万倍。pH突跃范围为4.3~9.7,此范围很大,包括从弱酸性到弱碱性区域。因此,在弱酸性范围内变色的指示剂(如甲基橙、甲基红)和在弱碱性范围内变色的指示剂(如酚酞)都适用。由于滴定曲线突跃大,终点变色敏锐。
乙酸为弱酸(pKa=4.76,Ka为离解常数),其 pH突跃范围为7.7~9.7,只有两个pH单位,且处于弱碱性范围内,应选用在碱性范围内变色的指示剂,如酚酞。如果用甲基橙为指示剂,在滴定终点时,被中和的乙酸大约只有30%,且变色缓慢。
如果用氢氧化钠滴定更弱的硼酸(pKa=9.25),在等当点附近,曲线很平,几乎没有突跃,就是说,加入大量氢氧化钠溶液时pH的变化很小,即使找到在等当点变色的指示剂,颜色变化也必定是极其缓慢的,实际上将无法确定终点。
用酸滴定碱的情况与碱滴定酸类似,强酸滴定弱碱的突跃范围处于酸性范围内,被滴定的碱越弱,突跃越小,就难以用指示剂确定终点。为使突跃加大,一般选强酸、强碱为滴定剂,而且浓度不能太小。
其他各类滴定曲线与酸碱滴定曲线类似,只是表示的方法不同。在络合滴定(见络合滴定法)曲线中,以pΜ代替pH(Μ为金属离子浓度);在沉淀滴定(见沉淀滴定法)曲线中,也以pΜ代替pH;在氧化还原滴定(见氧化还原滴定法)曲线中,则以电位 E代替pH。
滴定曲线可由计算求得,也可通过测定电位直接得到。用指示剂变色确定终点利用了等当点附近离子浓度的较大变化,只有在反应比较完全和pH突跃范围大时变色才明显。如果因其反应完全度低、突跃太小,可利用其他性质,如电导、吸光度的变化作测定,称为电导滴定(见电导分析法)和光度滴定。两法中记录整个滴定过程中溶液性质的变化,由两条直线(或其延长线)的交点确定终点。如果反应比较完全,则等当点及其附近的点都在两条直线上;对反应完全度较差的滴定,等当点及其附近的点虽然不在两条直线上,但由两条直线的延长线相交,仍可较准确地确定终点。
| 关于“滴定曲线”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |