医用化学/酸碱反应
| 医学电子书 >> 《医用化学》 >> 电解质溶液 >> 酸碱质子理论 >> 酸碱反应 |
| 医用化学 |
|
|
酸碱质子理论中的酸碱反应是酸碱之间的质子传递。例如:
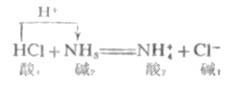
这个反应无论在水溶液中、苯或气相中,它的实质都是一样的。HCL是酸,放出质子给NH3,然后转变成共轭碱CL-,NH3是碱,接受质子后转变成共轭酸NH4+。强碱夺取了强酸放出的质子,转化为较弱的共轭酸和共轭碱。
酸碱质子理论不仅扩大了酸碱的范围,还可以把酸碱离解作用、中和反应、水解反应等,都看作是质子传递的酸碱反应。
由此可见,酸碱质子理论更好地解释了酸碱反应,摆脱了酸碱必须在水中才能发生反应的局限性,解决了一些非水溶剂或气体间的酸碱反应,并把水溶液中进行的某些离子反应系统地归纳为质子传递的酸碱反应,加深了人们对酸碱和酸碱反应的认识。但是酸碱质子理论不能解释那些不交换质子而又具有酸碱性的物质,因此它还存在着一定的局限性。
路易斯提出的酸碱电子理论是目前概括最广的酸碱理论。该理论认为,凡是能给出电子对的物质叫做碱;凡是能接受电子对的物质叫做酸。即酸是电子对的接受体,碱是电子对的给予体。因此,碱中给出电子的原子至少有一对孤对电子(未成键的电子对),而酸中接受电子的原子至少有一个空轨道(外层未填充电子的轨道),以便接受碱给予的电子对,这种由路易斯定义的酸和碱叫做路易斯酸和路易斯碱。例如,三氟化硼(BF3)是路易斯酸,因为BF3中的B原子有一个空轨道是电子的接受体。NH3中N原子有一对孤对电子,是电子对的给予体,为路易斯碱。但是,由于酸碱电子理论概括的酸碱范围太宽,使其实用价值受到一定的限制。
出自A+医学百科 “医用化学/酸碱反应”条目 http://www.a-hospital.com/w/%E5%8C%BB%E7%94%A8%E5%8C%96%E5%AD%A6/%E9%85%B8%E7%A2%B1%E5%8F%8D%E5%BA%94 转载请保留此链接
| 关于“医用化学/酸碱反应”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |