医用化学/水的离子积和溶液的PH值
| 医学电子书 >> 《医用化学》 >> PH值与缓冲溶液 >> 水的离子积和溶液的PH值 |
| 医用化学 |
|
|
一、水的离子积
水是一种既能释放质子也能接受质子的两性物质。水在一定程度上也微弱地离解,质子从一个水分子转移给另一个水分子,形成H3O+和OH-。
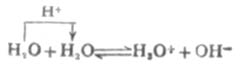
达到平衡时,可得水的离解常数Ki
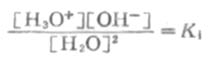
或[H2O+][OH-]=K1[H2O]2
由于水的离解度极小,[HO]数值可以看作是一个常数,令K1[H2O]2等于另一新常数Kw,则
[H3O+][OH-]=Kw
Kw称为水的离子积常数,简称水的离子积。上式表示在一定温度时,水中氢离子浓度与氢氧离子浓度的乘积为一常数(表3-1)。25℃时,由实验测出在纯水中[H3O+]和[OH-]各为1.0×10-‑7mol.L-1。通常将水合离子H3O+简写为H+,这样,在常温时:
表3-1 不同湿度时水的离子积
| 温度/℃ | KW | I温度/℃ | KW |
| 0 | 1.2×10-15 | 50 | 5.5×10-14 |
| 10 | 3.0×10-15 | 60 | 9.6×10-14 |
| 20 | 6.8×10-15 | 70 | 1.6×10-18 |
| 25 | 1.0×10-14 | 80 | 2.5×10-13 |
| 30 | 1.5×10-14 | 90 | 3.8×10-13 |
| 40 | 2.9×10-14 | 100 | 5.5×10-13 |
K=1.0*10-7*1.0*10-7=1.0*1014
[H+][OH-]=1.0*10-14 (3-2)
由于水离解时要吸收大量的热,所以温度升高,水的离解度和KW也相应地增大。
水的离子积原理不仅适用于纯水,也适用于一切稀的水溶液。在任何稀的水溶液中,不论[H+]和[OH-]怎样改变,它们的乘积总是等于KW。
二、溶液的PH值
在纯水或中性溶液中,25℃时
![]()
当向水中加入酸时,溶液中[H+]就会增大,设达到新的平衡时该溶液的[H+]为1.0×10-2mol.L-1,因[H+][OH-]=1.0×10-14,则
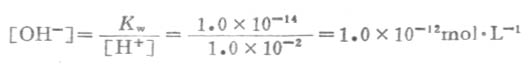
可见,在酸性溶液中,[H+]>1.0×10-7 mol.L-1,而[OH-]<1.0×10-7 mol.L-1.
如果向纯水中加入碱时,溶液中[OH-]就会增大,设达到新的平衡时该溶液的[OH-]为1.0×10-2mol.L-1,同理计算出[H+]=1.0×10-12 mol.L-1。可见,在碱性溶液中[OH-]>1.0×10-7mol.L-1,而[H+]<1.0×10-7 mol.L-1。由上述三种情况可知:
在纯水或中性溶液中 [H+]=1.0×10-7 mol.L-1=[OH-]
在酸性溶液中[H+]>1.0×10-7mol.L-1>[OH-]
在碱性溶液中[H+]<1.0×10-7mol.L-1<[OH-]
当然,[H+]或[OH-]都可用来表示溶液中的中性、酸性或碱性,但实际应用中多采用[H+]来表示。但是,在生物学与医学上许多重要溶液的[H+]往往是一个很小的数值,而且带有负指数,用[H+]表示溶液的酸碱性不方便。例如,人的血液[H+]为0.0000000398mol.L-1,即3.98×10-8 mol.L-1,血液究竟是酸性还是碱性,不容易看清楚。索仑生(Sorensen)首先提出用PH值表示水溶液的酸碱性。
溶液的PH值是氢离子浓度的负对数值。
它的数学表示式为:pH=-lg[H+]
即 [H+]=10-pH(3-3)严格地说,考虑活度时:
Pα+=lgαH+ (3-4)
必须注意,PH值每相差一个单位时,其[H+]相差10倍;PH值相差二个单位时,[H+]相差100倍;依此类推。
用PH值表示稀的水溶液的酸碱性,则有“
在纯水或中性溶液中, [H+]=1.0×10-7 mol.L-1 PH=7
在酸性溶液中, [H+]>1.0×10-7mol.L-1 PH<7 ,PH越小,则酸性越强。
在碱性溶液中, [H+]<1.0×10-7 mol.L-1 PH>7,PH越大,则碱性越强。
和PH相仿,[OH-]和KW也可用它们的负对数来表示,即
pOH=-lg[OH-] (3-5)
pKw=-lgKw (3-6)
由于在25℃时,[H+][OH-]=KW=1.0×10-14
将方程两边取负对数,则得
-lg[H+]-lg[OH-]=-lgKw=-lg1.0*10-14
所以
pH+pOH=pKw=14 (3-7)
水溶液中[H+],[OH-],PH,POH值与溶液酸碱性的关系如表3-2。
表3-2 [H+],[OH-],PH,POH值与溶液酸碱性的关系
| [H+] | 100 | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | 10-6 | 10-7 | 10-8 | 10-9 | 10-10 | 10-11 | 10-12 | 10-13 | 10-14 |
| PH | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
|
的酸 碱性 |
中酸性逐渐增强性 碱性逐渐增强 | ||||||||||||||
| POH | 14 | 13 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 | 0 |
| [OH-] | 10-14 | 10-13 | 10-12 | 10-11 | 10-10 | 10-9 | 10-8 | 10-7 | 10-6 | 10-5 | 10-4 | 10-3 | 10-2 | 10-1 | 100 |
在实际应用中,PH值一般只限于0-14范围内。当 [H+]或[OH-]大于(即100)时,就不再采用PH值,而仍用[H+]或[OH-]表示溶液的酸碱性。
必须注意,用PH值表示的是溶液的酸度或有效酸度而不是酸的浓度。酸度或有效酸度是指溶液中H+浓度,严格地说是指H+的活度,是指已离解部分酸的浓度。酸的浓度也称总酸度或分析浓度,它是指在1升溶液中所含酸的物质的量,包括已离解和未离解两部分酸的总浓度,其大小要用滴定分析来确定。酸度或有效酸度则用PH试纸或PH计来测定。潜在酸度是指未离解部分的浓度,即总酸度与有效酸度之差。例如,0.01mol.L-1HCL和0.01 mol.L-1HOAc的浓度相同,但有效酸度不同。0.01 mol.L-1HCL溶液总酸度为0.01mol.L-1,其有效酸度[H+]也是相同数值,25℃时,总酸度为0.01mol.L-1的HOAc溶液,其有效酸度[H+]则仅为4.2×10-4mol.L-1。
例1 分别求出0.1mol.L-1 HCl溶液和0.01mol.L-1 HOAc溶液的pH值,已知其[H+]分别为0.01mol.L-1和4.2*10-4mol.L-1。
解:HCl溶液的pH=-lg0.01=-lg10-2=2.0
HOAc溶液的pH=-lg(4.2*10-4)
=[0.62+(-4)]
=3.38
例2 已知某溶液的pH=4.60,计算该溶液的氢离子浓度。
解:-lg[H+]=pH=4.60
lg[H+]=4.60=-5+0.40=5.40
查0.4的反数为2.512,故
[H+]=2.512*10-5mol.L-1
三、PH值在医学上的应用
医学上常用PH来表示体液的酸碱性(见表3-3)。PH值在医学上具有很重要的意义,例如,正常人血浆的PH值相当恒定,保持在7.35-7.45之间,如果血液的PH值大于7.5,在临床上就表现出明显的碱中毒.反之,当血液的PH值小于7.3时,则表现出明显的酸中毒。
测定溶液中PH值的方法很多,临床上常用PH试纸测定病人尿液的PH值。更为精确的测定PH值,要使用PH计。
表3-3 人体各种体液的PH值
| 体液 | PH | 体液 | PH |
| 血清 | 7.35~7.45 | 大肠液 | 8.3~8.4 |
| 成人胃液 | 0.9~1.5 | 乳 | 6.6~6.9 |
| 婴儿胃液 | 5.0 | 泪 | 7.4 |
| 唾液 | 6.35~6.85 | 尿 | 4.8~7.5 |
| 胰液 | 7.5~8.0 | 脑脊液 | 7.35~7.45 |
| 小肠液 | 7.6左右 |
| 关于“医用化学/水的离子积和溶液的PH值”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |